科学家认为,氢气是一种高效而无污染的理想能源,近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是 。(选填字母)
| A.电解水 | B.锌和稀硫酸反应 |
| C.光解海水 | D.分解天然气 |
(2)用水分解获得氢气的能量变化如右图所示,表示使用催化剂是曲线 。该反应为 (放热还是吸热)反应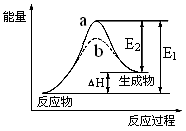
(3)1g的氢气完全燃烧生成液态水释放出142.9kJ的热量写出其完全燃烧的热化学方程式: 。
(4)利用氢气和CO合成二甲醚的三步反应如下:
① 2H2(g) + CO(g)  CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1
② 2CH3OH(g)  CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
③ CO(g) + H2O(g)  CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
总反应:3H2(g) + 3CO(g)  CH3OCH3(g) + CO2 (g)的ΔH=
CH3OCH3(g) + CO2 (g)的ΔH=
(5)氢氧燃料电池能量转化率高,具有广阔的发展前景。现用氢氧燃料电池进行下图所示实验: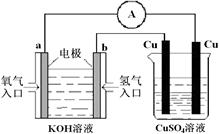
①氢氧燃料电池中,正极的电极反应式为 。
②上图装置中,某一铜电极的质量减轻3.2g,则 a 极上消耗的O2在标准状况下的体积为
L。
(6)有人设想寻求合适的催化剂和电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液制取新型燃料电池。则正极电极方程式 。
盐酸、硫酸和硝酸是三种重要的酸。
(1)工业上生产盐酸与硝酸时,都要用到的气态反应物是_______;
(2)工业上生产硫酸与硝酸时,用到的相同的重要设备是_______;
(3)工业生产中欲制得高浓度的硫酸与硝酸,可使用的相同物质是_______;
(4)浓盐酸与浓硝酸暴露在空气中,相同的现象是_______;
(5)浓硫酸与浓硝酸都可用铁、铝容器贮存的相同原理是_______;
(6)实验室制备H2、CO2、H2S、SO2时,用盐酸和浓硫酸可制备的相同气体是_______。
我们用字母L、M、Q、R、X分别代表五种含不同化合价的氮元素的物质,并且每种物质中氮元素的化合价只有一种。又知道物质L中氮元素的化合价要比物质M中氮元素的化合价低,并且在一定条件下,它们会有如下的相互转换关系(未配平):
①Q+HCl→M+Cl2;
②R+L→X+H2O;
③R+O2→L+H2O.
(1)已知这五种物质中有一种是硝酸,那么硝酸应该是L、M、Q、R、X中的________(填字母),判断的依据是_________________________________________________。
(2)反应③是在催化剂(如铂、氧化铁等)存在,并且加热到一定温度时发生的,这个反应在工业上有重要的应用。请据此推断,若物质X是密度比CO2密度小的气体,那么X的化学式是__________.
(3)某同学写出下面三个不同价态的氮的化合物相互转换的关系(未配平):
a、NO+HNO3→N2O3+H2O
b、NH3+NO→HNO2+H2O
c、N2O4+H2O→HNO3+HNO2
其中你认为一定不可能实现的是________________________________(填编号).
A、 B、C、D 四种元素, A B C的电子层数之和为5,A B能形成AB3分子,C元素的最高正价与其最低负价的绝对值相等,D的最外层电子数是次外层电子数的3倍。
(1)某物质含有上述四种元素中的2种,其空间构型为正四面体,该微粒的化学式为_____
(2)某盐含有上述四种元素,其水溶液显酸性。它与NaOH以物质的量之比(下同)1:1反应时无气体产生,1:2时能产生气体。该盐与盐酸反应生成含2个碳原子的酸,写出该盐的化学式___________ 。写出该盐与与NaOH以物质的量之比1:2反应的离子方程式___________。用方程式解释该盐水溶液显酸性的原因?__________________________________________。
奥美拉唑(Omeprazole)是基于2005年诺贝尔医学奖成果研制的药物,该药物对幽门螺旋杆菌引起的胃及十二指肠溃疡根治率最高。奥美拉唑的合成路线如下(Me表示甲基):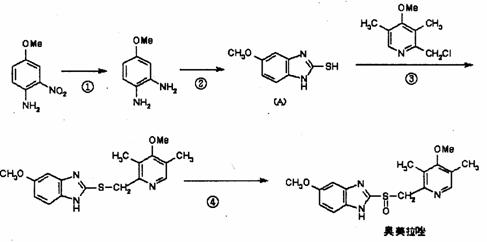
试回答下列
(a)写出反应类型①____________反应,③_____________反应,④_____________反应。
(b)反应②是与一种无机小分子反应(在氢氧化钾作用下),一分子与一分子反应时脱去一分子硫化氢得到(A)的,这种无机小分子化学式为:_________________。
(c)为使最终产品尽量少含杂质,反应过程中不产生污染物,你认为反应④中选用一种理想的无机试剂应是_________________(填化学式)。
今有A、B、C三种二甲苯,将它们分别进行一硝化反应,得到产物分子式都是C8H9NO2,但A得到两种产物,B得到三种产物,C只得到一种产物。由此可判断A、B、C是下列哪一种结构,请将字母填入结构式后面的括号中。