t℃时,在两个相同的密闭刚性容器(等容)中分别进行SO2和SO3相互转化的实验,反应的化学方程式为2SO2(g)+O2(g) 2SO3(g),实验Ⅰ和实验Ⅱ情况分别为图Ⅰ和图Ⅱ所示:
2SO3(g),实验Ⅰ和实验Ⅱ情况分别为图Ⅰ和图Ⅱ所示:
数据分析发现:达到平衡时,化学状态Ⅰ和化学状态Ⅱ完全相同。下列叙述不正确的是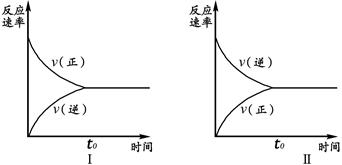
| A.若实验ⅠSO2的起始浓度为1mol/L,则实验ⅠO2的起始浓度为0.5mol/L;实验ⅡSO3的起始浓度为1mol/L. |
| B.若实验ⅠSO2的转化率为a%,则实验ⅡSO3 的转化率为1-a%。 |
| C.若起始浓度C(SO2) m mol/L,C(O2)=" n" mol/L,C(SO3)=" p" mol/L,在相同条件下进行实验,要求达到平衡时的状态与实验Ⅰ、Ⅱ完全相同,则m、n、p必须满足的条件是m/n="2" 和 m+p=1。 |
| D.维持实验Ⅰ的起始浓度和实验温度不变,改密闭刚性容器为密闭可变体积容器(等压容器)进行实验,达到化学平衡时:SO2的转化率与实验Ⅰ中SO2的转化率相比要小,但正反应速率与实验Ⅱ相比要大。 |
下列说法正确的是( )
| A.0.5mol SO2和11.2LCO2所含的分子数目一定相等 |
| B.25℃和100℃时,水的pH相等 |
| C.中和等体积、等物质的量浓度的NaOH和氨水所消耗的n(H2SO4)相等 |
D.2SO2(g)+O2(g) 2SO3(g) 和4SO2(g)+2O2(g) 2SO3(g) 和4SO2(g)+2O2(g) 4SO3(g)的△H相等 4SO3(g)的△H相等 |
下列描述违背化学原理的是( )
| A.“冰,水为之,而寒于水”说明相同质量的水和冰,水的能量高 |
B.反应A(g)+3B(g)  2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大 2C(g)达平衡后,温度不变,增大压强,平衡正向移动,平衡常数K值增大 |
| C.SO2的催化氧化是一个放热的反应,升高温度,反应速率加快 |
| D.饱和石灰水中加入少量CaO,恢复到原温度时,溶液中c(OH-)不变,OH-数目减少 |
有失去标签的A、B、C、D四瓶溶液,它们的成分可能是Na2CO3、K2SO4、Ba(NO3)2、NaHSO4中的某一种,进行下列实验:
(1)A+C→溶液①+气体①(2)B+A→溶液②+沉淀①
(3)C+B→溶液③+沉淀②(4)溶液③+沉淀①→溶液④+气体①
根据上述实验结果,写出上述过程的离子方程式:
(1)。
(2)。
(3)。
(4)。
已知:在水溶液或融熔状态下能导电的化合物叫电解质。现有以下物质:①NaCl晶体②液态SO3③液态的醋酸④汞⑤BaSO4固体⑥纯蔗糖(C12H22O11)⑦酒精(C2H5OH)⑧熔化的KNO3,请回答下列问题(填序号):
(1)以上物质中能导电的是;
(2)以上物质中属于电解质的是;
(3)以上物质中溶于水后形成的水溶液能导电的是。
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水。工业上常通过以下两步反应制备K2FeO4:①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O ②Na2FeO4 + 2KOH=K2FeO4 + 2NaOH
下列说法不正确的是
| A.反应①为氧化还原反应,反应②为复分解反应 |
| B.反应①中Na2FeO4是还原产物 |
| C.Na2FeO4 中Fe为+6价,具有强氧化性,能杀菌消毒 |
| D.若有2 mol FeCl3发生反应,转移电子的物质的量为 6 mol |