下表是25°C时某些盐的浓度积常数和弱酸的电离平衡常数,下列说法正确的是
| 化学式 |
AgCl |
Ag2CrO4 |
CH3COOH |
HClO |
H2CO3 |
| KSP或Ka |
KSP=1.8×10-10 |
KSP=2.0×10-12 |
Ka=1.8×10-5 |
Ka=3.0×10-8 |
Ka1=4.1×10-7 Ka2=5.6×10-11 |
A.相同浓度CH3COONa和NaClO的混合液中,各离子浓度的大小关系是
c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B.碳酸钠溶液中滴加少量氯水的离子方程式为CO32-+Cl2=HCO3-+Cl-+HClO
C.向0.1mol·L-1CH3COOH溶液中滴加NaOH溶液至c(CH3COOH):c(CH3COO-)=5:9,此时溶液pH=5
D.向浓度均为1×10-3mol·L-1的KCl和K2CrO4混合液中滴加1×10-3mol·L-1的AgNO3溶液,CrO42-先形成沉淀
铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O= Fe(OH)2+2Ni(OH)2
下列有关该电池的说法不正确的是()
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH――2e-="Fe" (OH)2 |
| C.电池充电过程中,阴极附近溶液的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O |
工业从铝土矿(主要成分是Al2O3·xH2O、SiO2、Fe2O3等)提取纯Al2O3做冶炼铝的原料,提取时操作过程如下图,图中操作错误的是()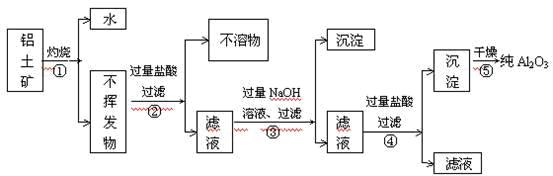
A④⑤ B③④ C②⑤ D①②
用右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。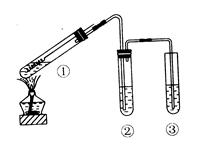 下列实验不合理的是()
下列实验不合理的是()
| A.上下移动①中铜丝可控制SO2的量 |
B.②中选用品红溶液验证S O2的生成 O2的生成 |
| C.③中选用NaOH溶液吸收多余的SO2 |
| D.为确认CuSO4生成,向①中加水,观察颜色 |
已知氯化银在水中存在沉淀溶解平衡:AgCl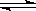 Ag+ + Cl-,现将足量的氯化银分别放入下列选项的溶液中,充分搅拌后,相同温度下,银离子浓度最小的是()
Ag+ + Cl-,现将足量的氯化银分别放入下列选项的溶液中,充分搅拌后,相同温度下,银离子浓度最小的是()
| A.100mL蒸馏水中 | B.50mL0.1mol•L-1的氯化镁溶液 |
| C.150mL0.1mol•L-1的氯化钠溶液 | D.50mL0.1mol•L-1的氯化铝溶液 |
某温度下,满足下列条件的溶液肯定呈酸性的是()
| A.加酚酞显无色的溶液 | B.含有H+的溶液 |
| C.pH<7的溶液 | D.c(H+)>c( OH―)的溶液 OH―)的溶液 |