已知氯化银在水中存在沉淀溶解平衡:AgCl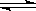 Ag+ + Cl-,现将足量的氯化银分别放入下列选项的溶液中,充分搅拌后,相同温度下,银离子浓度最小的是( )
Ag+ + Cl-,现将足量的氯化银分别放入下列选项的溶液中,充分搅拌后,相同温度下,银离子浓度最小的是( )
| A.100mL蒸馏水中 | B.50mL0.1mol•L-1的氯化镁溶液 |
| C.150mL0.1mol•L-1的氯化钠溶液 | D.50mL0.1mol•L-1的氯化铝溶液 |
一氧化碳、甲烷和乙烷组成的混合气体8.96L(标准状况),在足量氧气中充分燃烧后,生成气体先通过足量浓硫酸.再通过足量氢氧化钠溶液,测知氢氧化钠溶液增重26.4g,则原混合气体中乙烷的物质的量为()
| A.0.1mol | B.大于或等于0.2mo1,小于0.3mol |
| C.等于0.2 mol | D.大于0.1mol小于0.3mol |
香花石由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,X、Y、Z为金属元素,Z的最外层电子数与次外层相等,X、Z位于同主族,Y、Z、R、T位于同周期,R最外层电子数为次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是( )
| A.原子半径:Y>Z>R>T |
| B.气态氢化物的稳定性:W<R<T |
| C.最高价氧化物对应的水化物碱性:X>Z |
| D.XR2、WR2两化合物含有的化学键的类型相同 |
273K时,反应2SO2(g)+O2(g)  2SO3(g)生成2molSO3,放出393.2kJ的热量。在该温度下,情况1:向一固定容积的密闭容器内通入2molSO2和1molO2,达到平衡时,放出热量为Q1;情况2:向另一容积相同的密闭容器中通入1molSO2和0.5mol O2,达到平衡时放出热量为Q2;则下列判断不正确的是()
2SO3(g)生成2molSO3,放出393.2kJ的热量。在该温度下,情况1:向一固定容积的密闭容器内通入2molSO2和1molO2,达到平衡时,放出热量为Q1;情况2:向另一容积相同的密闭容器中通入1molSO2和0.5mol O2,达到平衡时放出热量为Q2;则下列判断不正确的是()
| A.同时进行时,情况1的反应速率(SO2)比情况2的大 |
| B.平衡时,情况1:Q=393.2kJ |
| C.达到平衡时,混合气体的密度,情况1比情况2大 |
| D.平衡时,情况2:Q<196.6kJ |
如下图所示,杠杆AB两端分别挂有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中,不考虑铁丝反应及两球的浮力变化):( )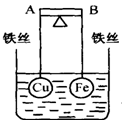
| A.杠杆为导体和绝缘体时,均为A端高B端低 |
| B.杠杆为导体和绝缘体时,均为A端低B端高 |
| C.当杠杆为绝缘体时,A端低,B端高;为导体时,A端高,B端低 |
| D.当杠杆为绝缘体时,A端高,B端低;为导体时,A端低,B端高 |
主链含5个碳原子,支链含有一个甲基、一个乙基的烷烃有:( )
| A.2种 | B.3种 | C.4种 | D.5种 |