氯气是一种重要的工业原料。
Ⅰ.实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是 。
Ⅱ.某研究性学习小组查阅资料得知,漂白粉与硫酸反应可制取氯气,化学方程式为:
Ca(ClO)2+CaCl2+2H2SO4  2CaSO4+2Cl2↑+2H2O
2CaSO4+2Cl2↑+2H2O
他们利用该反应设计如下制取氯气并验证其性质的实验。
(1)回答下列问题:(1)该实验中A部分的装置是 (填标号) 。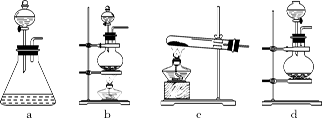
(2)请你帮助他们设计一个实验,证明洗气瓶C中的Na2SO3已被氧化(简述实验步骤): 。
(3)写出D装置中发生反应的离子方程式 (4)该实验存在明显的缺陷,请你提出改进的方法 。
(5)该小组又进行了如下实验:称取漂白粉2.0 g,研磨后溶解,配制成250 mL溶液,取出25 mL加入到锥形瓶中,再加入过量的KI溶液和过量的H2SO4溶液,静置。待完全反应后,用0.1 mol·L−1的Na2S2O3溶液作标准液滴定反应生成的碘,已知反应方程式为:2Na2S2O3+I2 === Na2S4O6+2NaI,共用去Na2S2O3溶液20.0 mL。则该漂白粉中Ca(ClO)2的质量分数为 。
下图是从苯酚的乙醇溶液中分离回收苯酚的操作流程图:

根据图示完成下列 问题:
问题:
(1)试剂A的化学式为 ______________.
______________.
(2)步骤③的操作名称为________________.
(3)写出C+D―→E+C6H5OH的化学方程式:____________________________ _______.
_______.
(8分)在一体积为1 L的容器中,通入一定量的N2 O4,在100℃时发生如下反应:
(1)在0-60s这段时间内,以N2O4表示的平均反应速率为mol·L-1·s-1
(2)上述反应的平衡常数表达式为,升高温度K值(填“增大"、“减小”或“不变”)
(3)反应进行到100s时,若有一项条件发生变化,变化的条件不可能是(填选项序号)。
| A.降低温度 | B.通人氦气使其压强增大 | C.又往容器中充入N2O4 | D.使用催化剂 |
(4分)已知:C(s)+O2(g)  CO2(g)ΔH="-437.3" kJ·mol一1
CO2(g)ΔH="-437.3" kJ·mol一1
H2(g)+ O2(g)
O2(g)  H2O(g)ΔH ="-285.8" kJ·mol一1
H2O(g)ΔH ="-285.8" kJ·mol一1
CO(g)+ O2(g)
O2(g)  CO2(g)ΔH ="-283.0" kJ·mol一1
CO2(g)ΔH ="-283.0" kJ·mol一1
则煤的气化主要反应(碳和水蒸气反应生成一氧化碳和氢气)的热化学方程式是
(8分)四种短周期非金属元素A、B、C、D,原子序数依次增大。A是原子半径最小的元素,B原子的最外层电子数是次外层电子数的两倍,D在地壳中含量最大。请回答:
(1)B元素的原子结构示意图是。
(2)化合物CA3的电子式是,BD2分子的结构式为。
(3)丙为含有上述四种元素的常见无机酸式盐,则丙的化学式为。
某些化学反应可用下式表示(未配平):A+B→C+D+H2O
请回答下列问题:
(1)若A、C、D均含有氯元素,且A中氯元素的化合价介于C与D之间,写出该反应的离子方程式:___________________________________________。
(2)若C为氯化钠,D是能使澄清石灰水变浑浊的无味气体,则A与B的组合是(填俗名):A________________或________________ , B______________________。
(3)若A为紫红色金属,D为无色刺激性气体,请写出符合上式的化学方程式:____________________________________________。
(4)若C、D均为气体且分子具有相同的原子个数比,则符合上式化学方程式是:____________________________________________。
(5)若A为过氧化钠,B为硫酸,则C是____________,D是_______________。