(12分)双氧水、过硫酸钾是工业上常用的氧化剂、消毒剂。工业上以铂为阳极,铅或石墨为阴极,电解NH4HSO4溶液得过硫酸铵【(NH4)2S2O8】溶液,其工艺流程为: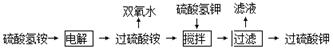
(1)将电解后的溶液送往水解器中在减压条件下水解、蒸馏、浓缩分离,精馏得过氧化氢的水溶液,剩余溶液再循环使用。
①写出电解NH4HSO4溶液的化学方程式
②写出水解器中(NH4)2S2O8溶液的水解方程式 。
③铂价格昂贵,试分析电槽阳极用铂不用铅的原因 。
④试分析水解器中使用减压水解、蒸馏的原因 。
(2)在电解后的过硫酸铵溶液中加入硫酸氢钾,析出过硫酸钾固体,过硫酸钾具有强氧化性,常被还原为硫酸钾,80℃以上易发生分解。
①将0.40 mol过硫酸钾与0.20 mol硫酸配制成1 L溶液,在80 ℃条件下加热并在t时刻向溶液中滴加入少量FeCl3溶液,测定溶液中各成分的浓度如右图所示(H+浓度未画出)。图中物质X的化学式为 。
②已知硫酸锰(MnSO4)和过硫酸钾(K2S2O7)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液。此反应的离子反应方程式 .
以下有水参与的化学反应都属于氧化还原反应,但水既不做氧化剂又不做还原剂的有。
①2Na2O2+2H2O=4NaOH+O2↑ ②Cl2+H2O="HCl+HClO"
③C+H2O=CO+H2④3NO2+H2O=2HNO3+NO
⑤2Na+2H2O=2NaOH+H2↑ ⑥2F2+2H2O=4HF+O2
(14分) 300℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g) 2C(g)+2D(g) △H=Q,2 min末达到平衡,生成0.8 mol D。
2C(g)+2D(g) △H=Q,2 min末达到平衡,生成0.8 mol D。
(1该反应的平衡常数表达式为:K= 。已知K300℃<K350℃,
则△H 0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为 ,D的平均反应速率为 。
(3)若温度不变,缩小容器容积,则A的转化率 (填“增大”减小”或 “不变”),
原因是 。
(4)如果在相同的条件下,上述反应从 逆反应方向进行,开始时若加入C、D各
逆反应方向进行,开始时若加入C、D各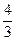 mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B mol。
mol。若使平衡时各物质的物质的量浓度与原平衡相同,则还应该加入B mol。
常温下,浓度均为0.1 mol·L-1的四种溶液:
①Na2CO3溶液②NaHCO3溶液③盐酸④氨 水
水
试回答下列问题:
(1)上述溶液中有水解反应发生的是 (填编号,下同),溶液中溶质存在电离平衡的是 ;
(2)比较①、②溶液,PH值较大的是 ;
(3)在溶液④中加入少量NH4Cl固体,此时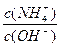 的值
的值
将 (填“变小”,“变大”或“不变”);
(4)用溶液③滴定V mL溶液④,其滴定曲线如下图所示: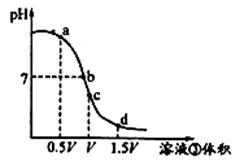
①试分析在滴定过程中,滴定曲线上a、b、c、d四点:
水的电离程度最大的是 点;
②取少量c点溶液于试管,再滴加0.1 mol/L NaOH溶液至中性。此时溶液中除H+、OH-外,其它离子浓度由大到小的顺序是 。
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一 配制并标定醋酸溶液的浓度
取冰醋酸配制250 0.2
0.2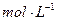 的醋酸溶液,用0.2
的醋酸溶液,用0.2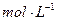 的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 0.2
0.2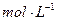 醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、
醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、
。
(2)为标定某醋酸溶液的准确浓度,用0.2000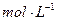 的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 |
1 |
2 |
3 |
4 |
| 消耗NaOH溶液的体积(mL) |
20.05 |
20.00 |
18.80 |
19.95 |
则该醋酸溶液的准确浓度为 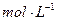 。(保留小数点后四位)
。(保留小数点后四位)
实验二 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋酸的pH,结果如下:
| 醋酸浓度 (mol·L–1) |
0.00l0 |
0.0100 |
0.0200 |
0.1000 |
| pH |
3.88 |
3.38 |
3.23 |
2.88 |
回答下列问题:
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是
。
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度 。(填“增大”、“减小”或“不变”)
实验三 探究温度对醋酸电离程度的影响
(5)请你设计一个实验完成该探究,请简述你的实验方案
。
(12分)现有①0.2 mol/L NaOH溶液 ②0.2 mol/LHX溶液,两溶液等体积混合后,测得溶液中c(Na+)>c(X-)。则:
(1)①中由水电离出的c(OH-)②中由水电离出的c(H+)(填“>”、“<”或“=”)。
(2)上述混合液中共存在种粒子,且c(HX)c(X-)(填“>”、“<”或“=”,下同),c(HX)+c(X-)0.1 mol/L(忽略体积变化)。
(3)上述混合液显性(填“酸”、“碱”或“中”),其原因用离子方程式表示为。