在容积为V L的密闭容器中发生2NO2 2NO+O2的反应。反应过程中NO2的物质的量随时间变化的状况如图所示。
2NO+O2的反应。反应过程中NO2的物质的量随时间变化的状况如图所示。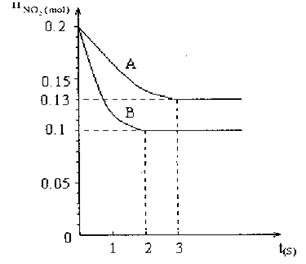
(1)若曲线A和B表示的是该反应在某不同条件下的反应状况,则该不同条件是
A.有、无催化剂 B.压强不同 C.温度不同
(2)写出该反应的化学平衡常数K的表达式 ,并比较K800℃ K850℃(填>、<或=)。
(3)求在B条件下从反应开始至达到平衡,氧气的反应速率VO2= 。
(4)能说明该反应已达到平衡状态的是
A.V正(NO2)=V逆(NO)
B.C(NO2)=C(NO)
C.气体的平均摩尔质量不变
D.气体的密度保持不变
.(14分)分子式为C8H8O2的有机物A,E遇FeCl3溶液呈紫色,有机物之间的相互转化如图(部分反应条件略)。
请回答下列问题: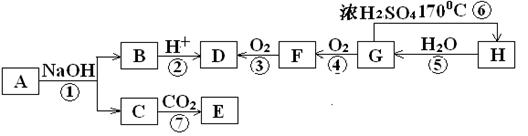
(1)H和F中含有的官能团的名称分别为、。(填写名称)
(2)有机物E的结构简式为。
(3)有机物G不能发生的反应类型有(填字母)。
| A.取代反应 | B.加成反应 | C.消去反应 | D.加聚反应 E.氧化反应 |
(4)有机物A的一种同分异构体X,能发生银镜反应,且含有与E相同的官能团。则X的同分异构体有种。
(5)写出反应③的化学反应方程式:;
写出反应⑥的化学反应方程式:。
(14分)电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a ;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: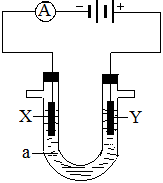
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,则电解池中X极上的电极反应为,在X极附近观察到的现象是:;Y电极上的电极反应式是。
(2)如果用电解方法精炼粗铜,电解液a选用CuSO4溶液,则X电极的材料是,电极反应式是,Y电极的材料是,电极反应式是。
.(10分)80℃时,将0.40mol的N2O4气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O4(g) 2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g)△H>0,隔一段时间对该容器内的物质进行分析,得到如下数据:
| 时间(s) n(mol) |
0 |
20 |
40 |
60 |
80 |
100 |
| n(N2O4) |
0.40 |
a |
0.20 |
c |
d |
e |
| n(NO2) |
0.00 |
0.24 |
b |
0.52 |
0.60 |
0.60 |
①计算20s—40s内用N2O4表示的平均反应速率为;
②计算在80℃时该反应的平衡常数K=;
③反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”、“变深”或“不变”);
④要增大该反应的K值,可采取的措施有(填序号)。
A.增大N2O4的起始浓度 B.向混合气体中通入NO2
C.使用高效催化剂 D.升高温度
⑤在同条件下,如果将0.40mol的N2O4气体充入2L已经抽空的固定容积的绝热密闭容器中,最终达到平衡后n(NO2)0.60 mol(填“> ”、“<”或“=”)。
(14分)化学反应速率和限度是中学化学原理中很重要部分,根据所学知识回答下列问题:
I、用纯净的锌粒与稀盐酸反应制取氢气气体,请回答: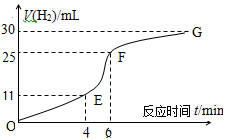
(1)实验过程如图所示,分析判断段化学反应速率最快。
(2)将锌粒投入盛有稀盐酸的烧杯中,刚开始时产生H2的速率逐渐加快,其影响因素是,一定时间后反应速率逐渐减慢,其原因是。
(3)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是( )
| A.蒸馏水 | B.氯化钠固体 | C.氯化钠溶液 | D.浓盐酸 E.降低温度 |
II、某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析: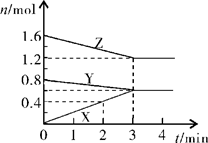
(1)该反应的化学方程式:;
(2)反应开始至2min末,X的反应速率为(mol·L-1·min-1);
(3)3min后图中曲线所表示的含义是。
.(14分)已知:①A 是一种分子量为28的气态烃;②2CH3CHO+O2 2CH3COOH。现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示(每步都使用了催化剂)。
2CH3COOH。现以A为主要原料合成一种具有果香味的物质E,其合成路线如图所示(每步都使用了催化剂)。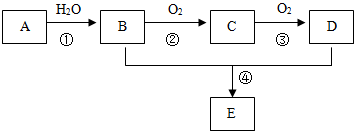
回答下列问题
(1)写出A的结构简式。
(2)B、D分子中的官能团名称分别是、。
(3)写出下列反应的反应类型:①;④。
(4)写出下列反应的化学方程式:②;
④。