Ⅰ.中和热的测定是高中重要的定量实验。50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
(1)从右图实验装置看,其中尚缺少的一种玻璃用品是 ,除此之外,装置中的一个明显错误是 。
(2)大烧杯上如不盖硬纸板,求得的中和热数值将 ________ (填“ 偏大”“偏小”或“无影响”)。
Ⅱ.酸碱中和滴定是中学化学常见实验。某学校化学课外小组用标准液盐酸滴定未知浓度的氢氧化钠溶液,试回答下列问题。
(1)滴定过程中,眼睛应注视 。
(2)在铁架台上垫一张白纸,其目的是 。
(2)某学生根据3次实验分别记录有关数据如下表:
| 滴定次数 |
待测NaOH溶液的体积/mL |
0.1000 mol/L盐酸的体积/mL |
||
| 滴定前刻度 |
滴定后刻度 |
溶液体积/mL |
||
| 第一次 |
25.00 |
0.00 |
26.11 |
26.11 |
| 第二次 |
25.00 |
1.56 |
30.30 |
28.74 |
| 第三次 |
25.00 |
0.22 |
26.31 |
26.09 |
依据上表数据列式并计算该NaOH溶液的物质的量浓度
。
(4)下列实验操作对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
a.观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果 。
b.若将锥形瓶用待测液润洗,然后再加入10.00 mL待测液,则滴定结果 。
明矾石经处理后得到明矾[KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4和H2SO4的工艺过程如下所示:
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O+3S 2K2SO4+2Al2O3+9SO2↑+48H2O
2K2SO4+2Al2O3+9SO2↑+48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是 。
(2)从水浸后的滤液中得到K2SO4晶体的方法是 。
(3)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 。
亚硫酸钠中+4价的硫,它既有氧化性又有还原性,现在有试剂:溴水、硫化钠溶液,NaOH溶液、氯化钡溶液、稀硫酸。
(1)要证明亚硫酸钠具有还原性,除亚硫酸钠外还应选用的试剂有 ,看到的现象是 ,反应的离子方程式 。
(2)要证明亚硫酸钠具有氧化性,除亚硫酸钠外还应选用的试剂有 ,看到的现象是 ,反应的离子方程式 。
按要求书写下列氧化还原反应方程式
(1)已知在过量的FeSO4溶液中滴入几滴NaClO溶液,并加入过量H2SO4,溶液立即变黄,试写出该反应的离子方程式:___________________________。
(2)将适量的SO2通入Fe(NO3)3溶液中,溶液逐渐由棕黄色变为浅绿色,但又立即变为棕黄色,请写出该过程中的离子方程式: , 。
(3)将NCl3与NaClO2(亚氯酸钠)按物质的量之比1∶6混合,在溶液中恰好反应生成ClO2,试写出该反应的离子方程式 。
按要求书写下列反应的离子方程式
(1)CuSO4溶液与过量Ba(OH)2溶液反应:
(2)Al2(SO4)3溶液中加入过量氨水:
(3)将过量SO2气体通入冷氨水中:
(4)向NaAlO2溶液中通入过量CO2:
(5)0.01 mol·L-1 NH4Al(SO4)2溶液与0.02 mol·L-1 Ba(OH)2溶液等体积混合:
利用氮气、氢气在一定条件下生成氨气这一可逆反应来合成氨,是一个重要的化工反应。常用来生产液氨和氨水。
完成下列填空:
(1)右图表示合成氨时生成1mol生成物时的能量变化,E的单位为kJ。请写出合成氨的热化学方程式 (热量用E1、E2或E3表示)。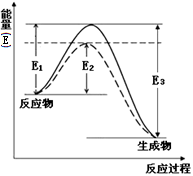
该图中的实线与虚线部分是什么反应条件发生了变化? 。
(2)在一定温度下,若将4amol H2和2amol N2放入VL的定容密闭容器中,2分钟后测得N2的转化率为50%,则该段时间用H2表示的反应速率为 摩尔/(升–秒)。若此时再向该容器中投入a mol H2、amol N2和2amol NH3,判断平衡移动的方向是 (填“正向移动”“逆向移动”或“不移动”)。
(3)液氨和水类似,也能电离:2NH3 NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K 2×10-30(填“<”、“>”或“=”);
NH4++ NH2-,某温度时,其离子积K=2×l0-30。该温度下:①将少量NH4Cl固体加入液氨中,K 2×10-30(填“<”、“>”或“=”);
②将少量金属钠投入液氨中,完全反应后所得溶液中各微粒物质的量大小排列为:
(4)工厂生产的氨水作肥料时需要稀释。用水稀释0.1mol/L稀氨水时,溶液中随着水量的增加而减少的是 。
a.c(NH4+)/c(NH3•H2O)b.c(NH3•H2O)/c(OH-)
c.c(OH-)/c(H+) d.c(H+)/c(NH4+)