加热16.8gNaHCO3至没有气体放出时,剩余的物质是什么?计算剩余物质的质量和物质的量。
(1)加热NaHCO3时发生的化学反应:___________________________
(2)剩余的物质是 ,质量为 ,物质的量为 。(写出计算过程)
近期,我国个别企业违法排污导致地下
水严重污染又成为媒体焦点。对水的质量监控
有很多指标,其中水中溶解氧(DO)的多少是衡量水体自净能力的一个指标。
I.对溶解氧(DO)的测定步骤是:
①在一定温度下量取100.00mL新鲜水样,在碱性条件下使其中的O2将Mn2+氧化为MnO(OH)2:
②向步骤①反应后的溶液中加入KI溶液,使其中生成的MnO(OH)2再还原成Mn2+: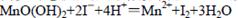
③最后用0.0100 mol·L-1Na2S2O3标准溶液滴定步骤②中生成的I2: ,
,
消耗Na2S2O3标准溶液11.00mL。
(1)步骤③使用的指示剂是淀粉试液。滴定终点时指示剂的颜色变化情况是____。
(2)硫代硫酸(H2S2O3)是一种二元弱酸。步骤③应选用____滴定管进行滴定,结合离子方程式说明原因:________。
(3)水样中溶解氧(DO)的浓度为mg·L-1。
II.该实验需用Na2S2O3固体配制100mL 0.0100 mol·L-1Na2S2O3标准溶液。
(4)请按配制的过程填写选用仪器的顺序:____(填编号)。
①玻璃棒②胶头滴管③100mL容量瓶④天平⑤25mL烧杯
(5)配制0.0100mol·L-1Na2S2O3标准溶液时,下列操作使所配溶液浓度偏高的是____。
| A.没有用蒸馏水洗涤烧杯 |
| B.定容时俯视容量瓶刻度线 |
| C.配制前容量瓶洗净后没干燥 |
| D.摇匀后见液面下降,再加水至刻度线 |
E.用天平称量药品时,左盘低,右盘高
Na2S2O3·5H2O在化学定量分析中常用作基准物质,实验室制备原理为:2Na2S+Na2CO3+4SO2 3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
3Na2S2O3+CO2。设计如下装置(夹持仪器省略)进行实验。
(1)A中发生的化学反应方程式为。
(2)C中所盛试剂可能是;若要停止A中的化学反应,除取下酒精灯停止加热外,还可以采取的操作是。
(3)学生乙在加热A后,发现液面下的铜丝变黑。对黑色生成物该学生提出如下假设:
①可能是CuO②可能是Cu2O③可能是CuS
学生丙提出假设②一定不成立,依据是;该生用如下实验进一步验证黑色物质的组成:
基于上述假设分析,黑色物质的组成为(填化学式)。
(4)实验室用Na2S2O3标液测量废水Ba2+的浓度,过程如下:
(已知:2 S2O32一+I2=S4O62—+2 I-) 
①写出BaCrO4沉淀与过量HI、HCl溶液反应的离子方程式;
②以淀粉为指示剂,则到达滴定终点的现象是;
③若标液Na2S2O3的浓度0.0030mol·L-1,消耗该Na2S2O3溶液体积如图,则废水Ba2+的浓度为。
纯碱和硫酸都是重要的化工原料,用途非常广泛。
(1)利用氨碱法得到的碳酸氢钠经煅烧生成纯碱。工艺流程如下图所示:
氨碱法示意图
图中的中间产物C是_________,D是________(写化学式);装置乙中发生反应的化学方程式为_________________________________。
(2)火山喷发所产生的硫磺可用于生产重要的化工原料硫酸。甲企业用接触法生产硫酸采用的主要原料是硫磺和空气。工艺流程如下图所示:
为了充分利用反应放出的热量,接触室中应安装____________(填设备名称)。吸收塔中填充许多瓷管,其作用是____________。为使硫磺充分燃烧,经流量计1通入燃烧室的氧气过量50%。为提高SO2的转化率,经流量计2的氧气量为接触室中SO2完全氧化时理论需氧量的2.5倍,则生产过程中流经流量计1和流量计2的空气体积比应为____________。
PM2.5(可入肺颗粒物)污染跟冬季燃煤密切相关,燃煤还同时排放大量的CO2、SO2和NOx
(1)最近有科学家提出构想:把空气吹入饱和碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。
①已知在常温常压下:
2CH3OH(l)+3O2(g) = 2CO2(g)+4H2O(g)∆H = -1275.6 kJ/mol
2CO(g)+O2(g)=2CO2(g)∆H = -566.0 kJ/mol
H2O(g)=H2O(1)∆H = -44.0 kJ/mol
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为_____________________。
②以甲醇和氧气反应制成的燃料电池如图所示,该电池工作过程中O2应从______(填“c”或“b”)口通入,电池负极反应式为__________________。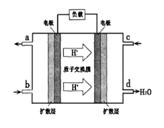
③25℃时,将甲醇燃烧生成的足量CO2通入到浓度为0.lmol·L-1,NaOH溶液中,所得溶液的pH=8,溶液中离子浓度由大到小的顺序是_________________。
(2)已知在一定条件下,NO与NO2存在下列反应:NO(g)+NO2(g)=N2O3(g),ΔH<0若该反应在绝热、恒容的密闭体系中进行,下列示意图能说明tl时刻达到平衡状态的是____________。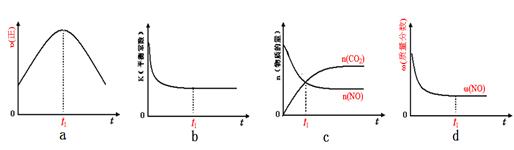
(3)在一个固定容积为5L的密闭容器中充入0.20molSO2和0.l0molO2,半分钟后达到平衡,测得容器中含SO30.18mol,则v(O2)=__________,若继续通入0.20mo1SO2和0.lmolO2,则平衡____________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(4)在一定条件下,NO2可以被NH3还原为N2来消除NO2对环境造成的污染。25℃时,将NH3溶于水得l00mL 0.lmol·L-的氨水,测得pH=11,则该条件下NH3·H2O的电离平衡常数约为___________。
工业碳酸钠(纯度约为98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42—等杂质,提纯工艺线路如图所示:
Ⅰ.碳酸钠的饱和溶液在不同温度下析出的溶质如图所示:
Ⅱ.有关物质的溶度积如下
| 物质 |
CaCO3 |
MgCO3 |
Ca(0H)2 |
Mg(OH)2 |
Fe(OH)3 |
| Ksp |
4.96×10-9 |
6.82×10-6 |
4.68×10-6 |
5.61×10-12 |
2.64×10-39 |
回答下列问题:
(1)加入NaOH溶液时,反应的离子方程式为。向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=。
(2)“母液”中除了含有Na+、CO32—外,还含有等离子。
(3)有人从“绿色化学”角度设想将“母液”沿流程中虚线进行循环使用。请你分析在实际工业生产中是否可行:(填“可行”或“不可行”),并说明理由:。
(4)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g) ="+532.36" kJ·mol-1
="+532.36" kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g) ="+473.63" kJ·mol-1
="+473.63" kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式:。