二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2—)。2001年我国卫生部规定,饮用水中ClO2—的含量应不超过0.2mg·L-1。
饮用水中CIO2、CIO2—的含量可用连续碘量法进行测定。CIO2被I—还原为CIO2—、Cl—的转化率与溶液pH的关系如下图所示。当pH≤2.0时,CIO2—也能被I—完全还原成Cl—。反应生成的I2用标准Na2S2O3溶液滴定:
2Na2S2O3+I2==Na2S4O6+2NaI
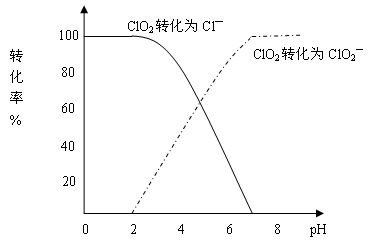
①请写出pH≤2.0时,CIO2—与I—反应的离子方程式 。
②请完成相应的实验步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的K I晶体。
步骤4:加少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5: 。
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
③根⑤据你现有的知识,写出步骤4滴定至终点的现象判断依据为
④根据上述分析数据,测得该饮用水样中CIO2—的浓度为 mol·L-1(用含字母的代数式表示。)
⑤若饮用水中ClO2— 的含量超标,可向其中加入适量的Fe2+将ClO2— 还原成Cl—-, 请猜测该反应的氧化产物是 (填化学式)。
已知pH=2的高碘酸(H3IO5)溶液与pH=l2的NaOH溶液等体积混合,所得混合溶液呈酸性, 0.01mol/L的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=l2的NaOH溶液等体积混合,所得混合溶液均呈中性, 请回答下列问题:
(1)高碘酸是(填写“强酸”或“弱酸”),原因是。
(2)已知高碘酸和硫酸锰在溶液中反应生成高锰酸和碘酸及硫酸, 此反应的氧化剂是________,反应的离子方程式为。
(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号)。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号)。
A.氨水与氯化铵发生化学反应 B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
①和两种粒子的物质的量之和等于0.1mol。
②和两种粒子的物质的量之和比OH―多0.05mol。 (4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是,上述离子浓度大小顺序关系中正确的是(选填序号)。
②若上述关系中C是正确的,则溶液中溶质的化学式是。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同)c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+)c(Cl-)。
某有机物A的蒸气与相同状况下同体积氢气的质量比是30,其分子中碳、氢的质量分数分别是40%、6.6%,其余为氧。
(1)该有机物的分子式为。
(2)若该有机物有水果香味,其结构简式为。
(3)若该有机物能与Na2CO3溶液反应,其结构简式为。
(4)若该有机物能与Na反应,但不与Na2CO3溶液反应,其结构简式为。
右图是部分短周期元素的单质熔点的变化图,根据此图,填写下列空格: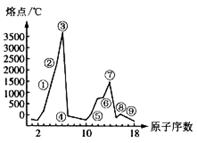
(1)③号元素位于周期表第______周期_______族,其单质的一种同素异形体能导电,该同素异形体的名称叫。
③号元素与氧气完全反应形成的化合物的电子式。
(2)⑤、⑥两种元素形成的最高价氧化物对应的水化物之间相互反应的离子方程式为___________________________________________。
⑤号元素在空气中加热与氧气反应形成的化合物的电子式为。
A、B、C是三种短周期元素,其中A元素原子M层上电子数比L层少2个电子;B元素原子比A元素原子的电子层少,又知B元素最高正价与负化合价的绝对值相等;C 元素的阳离子核外电子排布与Ne原子核外电子排布相同;且又知这三种元素可组成BA2型共价化合物和C2A型离子化合物。由上述条件回答下列问题:
(1)A、B、C三元素的名称分别是:A_______,B_______,C_______。
(2)化合物C2A的电子式是______________。
(3)化合物BA2的化学式是______________。