(1)在25℃条件下将pH=11的氨水稀释100倍后溶液的pH为(填序号) 。
A.9 B.13 C.11~13之间 D.9~11之间
(2)25℃时,向0.1mol/L的氨水中加入少量氯化铵固体,当固体溶解后,测得溶液pH减小,主要原因是(填序号) 。
A.氨水与氯化铵发生化学反应 B.氯化铵溶液水解显酸性,增加了c(H+)
C.氯化铵溶于水,电离出大量铵离子,抑制了氨水的电离,使c(OH―)减小
(3)室温下,如果将0.1mol NH4Cl和0.05mol NaOH全部溶于水,形成混合溶液(假设无损失),
① 和 两种粒子的物质的量之和等于0.1mol。
② 和 两种粒子的物质的量之和比OH―多0.05mol。 (4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
(4)已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测该溶液中各离子浓度大小顺序可能有如下四种关系:
A.c(Cl-)>c(NH4+)>c(H+)>c(OH-) B.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
C.c(Cl-)>c(H+)>c(NH4+)>c(OH-) D.c(NH4+)>c(Cl-)>c(OH-)>c(H+)
①若溶液中只溶解了一种溶质,该溶质的名称是 ,上述离子浓度大小顺序关系中正确的是(选填序号) 。
②若上述关系中C是正确的,则溶液中溶质的化学式是 。
③若该溶液中由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)(填“>”、“<”、或“=”,下同) c(NH3·H2O),混合后溶液中c(NH4+)与c(Cl-)的关系c(NH4+) c(Cl-)。
已知可逆反应2A(g)+B(g) 2C(g),向容积为0.5L的密闭容器中加入0.050mol A和0.025mol B,在500℃时充分反应,达平衡后测得
2C(g),向容积为0.5L的密闭容器中加入0.050mol A和0.025mol B,在500℃时充分反应,达平衡后测得 ,放出热量Q1 kJ。
,放出热量Q1 kJ。
(1)能说明上述反应已经达到化学平衡状态的是______________(填字母编号)
a.v(C)=2v(B)
b.单位时间内生成2mol A的同时消耗1molB
c.容器内压强保持不变
d.容器内气体的密度保持不变
e.单位时间内生成1molB的同时生成2mol A
f.容器内气体的平均分子量保持不变
g.容器内气体的质量保持不变
h.容器内A物质的浓度是B物质的2倍
(2)上述反应中A的转化率a(A)=。
(3)请写出上述反应的热化学方程式__________________。
(4)500℃时,上述反应的化学平衡常数K=____________________。
(5)一般,升高温度,化学反应的反应速率会增大。从以下图像中选择符合酶催化作用的化学反应速率随温度变化的特征 。
请按要求回答下列问题。
(1)根据下图回答①②。
①打开K2,闭合K1。A极电极反应式为_________________,B极的现象____________。
②B极重新换根碳棒,再打开K1,闭合K2。
B极电极反应式_______________________________。
装置发生的总反应化学方程式______________。实验完成后,锌电极增重a g,则阳极产生标准状况下的气体体积________L。
(2)改变两电极的电极材料,利用该装置要实现Cu+H2SO4== CuSO4+H2↑反应的发生,应打开____闭合_____,其电解质溶液需用,B电极材料是用,A电极反应式为。
高炉炼铁过程中发生的主要反应为:Fe2O3(s) + 3CO(g) 2Fe(s) + 3CO2(g)。已知该反应在不同温度下的平衡常数列于表中:
2Fe(s) + 3CO2(g)。已知该反应在不同温度下的平衡常数列于表中:
| 温度/℃ |
1000 |
1150 |
1300 |
| 平衡常数 |
64.0 |
50.653 |
42.875 |
(1)写出该反应的平衡常数表达式:K=_________。
(2)在一个容积为10L的密闭容器中,1000℃时加入Fe2O3、CO各1.0 mol,反应经过l0 min后达到平衡。求该时间范围内反应的平均反应速率υ(CO2)=;平衡时,c(CO)=。
(3)欲提高(2)中CO的反应速率,可采取的措施是_____________。
A.减少Fe的量
B.增加Fe2O3的量
C.移出部分CO2
D.提高反应温度
E.减小容器的体积
F.加入合适的催化剂
(4)在1L的密闭容器中,1300℃条件,下列达平衡状态的是。
| n(Fe2O3) |
0.350 |
0.027 |
0.080 |
0.080 |
| n(CO) |
0.010 |
0.010 |
0.010 |
0.050 |
| n(Fe) |
0.100 |
0.064 |
0.080 |
0.080 |
| n(CO2) |
0.035 |
0.088 |
0.040 |
0.050 |
(5)铁是国家的工业基础,下列哪些装置可防止铁棒被腐蚀 ________。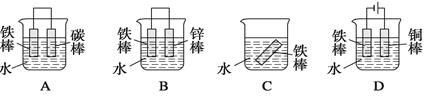
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施。化学反应的反应热通常用实验进行测定,也可进行理论推算。
(1)25℃下实验测得,5g甲醇在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式
(2)合成氨反应:1/2N2(g)+3/2H2(g) NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成34 gNH3(g),放出92.2 kJ的热量。请回答下列问题:
NH3(g),反应过程的能量变化如图所示。已知N2(g)与H2(g)反应生成34 gNH3(g),放出92.2 kJ的热量。请回答下列问题:
该反应通常用铁作催化剂,加催化剂会使图中E变_____(填“大”或“小”),图中ΔH=_________
(3)由气态基态原子形成1mol化学键释放的能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 |
H-H |
N-H |
N≡N |
| 键能/kJ·mol-1 |
436 |
391 |
945 |
已知反应N2(g)+3H2(g) 2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a 的值____。
2NH3(g) △H=a kJ·mol-1。试根据表中所列键能数据估算a 的值____。
(4)已知:△H2="+" 44 kJ·mol-1,△H3= -285.8kJ·mol-1
下图列出它们之间的转变关系。请计算298K时由H2O(g)生成1molH2(g)和1/2molO2(g)反应的△H1=(用△H2、△H3表示△H1计算等式),(计算△H1数据结果)。
(1)下列五种物质中①Ne ②H2O ③NH3④ KOH ⑤Na2O,只存在共价键的是,只存在离子键的是,既存在共价键又存在离子键的是,不存在化学键的是。(填写序号)
(2)在下列变化中,①碘的升华 ②烧碱熔化 ③MgCl2溶于水 ④HCl溶于水⑤O2溶于水,未发生化学键破坏的是,仅发生离子键破坏的是,仅发生共价键破坏的是。(填写序号)