将铁粉、铜粉、FeCl3溶液、FeCl2溶液和CuCl2溶液混合于某容器中充分反应(假定容器不参与反应),试判断下列情况下溶液中存在的金属离子和金属单质。
(1)若铁粉有剩余,则容器中不可能有_______________________________________;
(2)若氯化铜有剩余,则容器中还可能有__________________________________;
(3)若氯化铁和氯化铜都有剩余,则容器中不可能有________,可能有________;
(4)若氯化铁有剩余,则容器中不可能有________。
CO2、SO2、NOx是重要的非金属氧化物,与我们的生存环境息息相关。
(1)SO2、NOx是形成酸雨和光化学烟雾的环境污染性气体,研究发现,空气中少量的 NO2能参与硫酸型酸雨的形成,反应过程如下:
①SO2+NO2=SO3+NO②SO3+H2O=H2SO4 ③2NO+O2=2NO2。
则MnO2在下述变化中的作用与NO2在上述过程中的作用相似的是 (填选项)
A.实验室用MnO2和浓盐酸混合加热制氯气
B.实验室用氯酸钾和MnO2混合加热制氧气
C.双氧水加入MnO2制氧气
D.高锰酸钾受热分解为二氧化锰、锰酸钾和氧气
(2)请写出用上述选项A实验室制氯气反应的离子方程式 ,若利用B和C制备等量的氧气,则转移的电子数目之比为 。
(3)很多现代化的纯碱厂,纯碱生产工艺仍沿用我国化学家侯德榜改进的纯碱生产工艺,其生产流程可简要表示如下: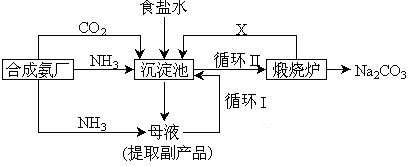
①上述生产纯碱的方法称侯德榜制碱法,沉淀池中发生的化学反应方程式是 。
②检验产品碳酸钠中是否含有氯化钠的操作方法为 。
③写出上述流程中X物质的分子式 ,副产品的一种用途为 。
④使原料氯化钠的利用率从70%提高到90%以上,主要是设计了 (填上述流程中的编号)的循环。
⑤向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有 。
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
废旧锌锰电池回收处理,既能减少它对环境的污染,又能实现废电池的资源化利用。
(1)回收二氯化锰。将废旧锌锰电池处理,得到含MnO(OH)混合物,向该混合物加入浓盐酸并加热,试写出MnO(OH)与浓盐酸反应的化学方程式: 。
(2)制备锰锌铁氧体。锰锌铁氧体可用作隐形飞机吸收雷达波的涂料。一种以锌锰废电池为原料制备锰锌铁氧体的主要流程如下: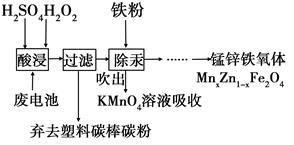
除汞时,铁粉的作用是______________ _(填“氧化剂”或“还原剂”或“吸附剂”);MnxZn1-xFe2O4中Fe元素为+3价,则Mn元素的化合价为 。
(3)在不同pH下,KMnO4溶液对Hg的吸收率的影响及主要产物如下图。
据图说明pH对Hg吸收率的影响规律 ;在强酸性环境下Hg的吸收率高的原因可能是 。
(4)锰回收新方法。向含锰混合物加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。其主要反应为:2MnO(OH)+ MnO2+2H2C2O4 +3H2SO4 = 3MnSO4+ 4CO2↑+6H2O
①每1molMnO2参加反应时,共有 mol电子发生转移。
②新方法的优点是 (答1点即可)。
研究氮、硫及卤素(F、Cl、Br、I)等单质及其化合物的反应在工农业生产、日常生活和环境保护中有重要意义。
(1)工业上利用氨在催化剂存在的情况下与氧气反应来制备生产硝酸所需要的一氧化氮,该反应的化学方程式为 。NH3的电子式为 。硝酸生产过程中排放出来的一氧化氮是大气污染物之一,目前有一种治理方法,是在400℃左右且有催化剂存在的情况下,用氨把一氧化氮还原成无色无毒气体,直接排入空气中,有关反应的化学方程式为 。
(2)已知在加热条件下浓硫酸能将木炭粉氧化,该反应的化学方程式为 。某学习小组设计实验来验证上述反应所产生的各种产物,将该反应生成的气体依次通过①装有无水硫酸铜的U型管 ②装有品红溶液的洗气瓶 ③装有酸性KMnO4溶液的洗气瓶 ④装有品红溶液的洗气瓶 ⑤装有澄清石灰水的烧杯,实验中能说明产物内含有CO2的现象是 。
(3)某学习小组欲探究氯气、溴单质、碘单质的氧化性强弱。该小组设计的实验操作依次为:①向NaBr溶液中通入氯气 ②向KI溶液中通入氯气,若要验证氧化性Cl2>Br2>I2,你认为该小组同学还需完成的实验是 (用离子方程式表示)。从原子结构的角度解释氯、溴、碘氧化性逐渐减弱的原因是 。
氧化还原反应在生产、生活中应用广泛,酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂.用所学知识回答问题:
(1)3H2SO4+2 KMnO4+5H2O2=K2SO4+2MnSO4+5 O2↑+8 H2O,当有6 mol H2SO4参加反应的过程中,有 mol还原剂被氧化.
(2)在稀硫酸中,KMnO4与H2C2O4反应的离子方程式为
(3)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是 mol.
(4)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是 ,又变为棕黄色的原因是 。
离子反应是中学化学中重要的反应类型.回答下列问题:
(1)在发生离子反应的反应物或生成物中,一定存在____________.
①单质 ②氧化物 ③电解质 ④盐 ⑤化合物
(2)可用图示的方法表示不同反应类型之间的关系.如分解反应和氧化还原反应可表示为下图.请在下面的方框中画出离子反应、置换反应和氧化还原反应三者之间的关系.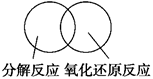

(3)离子方程式是重要的化学用语.下列是有关离子方程式的一些错误观点,请在下列表格中用相应的“离子方程式”否定这些观点.
| ①所有的离子方程式 均可以表示一类反应 |
|
| ②酸碱中和反应均 可表示为:H++OH―===H2O |
|
| ③离子方程式中凡 是难溶性酸、碱、盐均要用“↓” |
(4)试列举出三种不同类别的物质(酸、碱、盐)之间的反应,它们对应的离子方程式都可用“Ba2++SO42―=BaSO4↓”来表示,请写出有关反应的化学方程式(三个):
①_________________________________;
②_________________________________;
③_________________________________.