太阳能是一种清洁能源,它的利用前景非常诱人。下面是科学家正在研究的一种利用太阳能制取氢气的方法。
(1)首先利用太阳能加热装有氧化锌和木炭的混合物,当反应塔内的温度达到1200 ℃,可得到高纯度的锌粉。然后将制得的高纯度锌与400 ℃以上的水蒸气反应,得到氢气,氧化锌循环使用。请写出该过程涉及的化学方程式________________________、________________________________________________________________________
________________。
(2)若投入81 kg氧化锌粉,则理论上制得的氢气在标准状况下的体积为________L。
用铜、银与硝酸银设计一个原电池,此电池的负极是:,负极的电极反应式是:总反应方程式为 。
。
下列是用化学方程式表示的化学变化,请在每小题后的横线上注明能量的转化形式
H2O2、KCl、NaOH、Na2O2、HCl、O2中只含离子键的是,只含极性键的是,只含非极性键的是,既含离子键又含极性键的是,既含离子键又含非极性键的是,既有极性键又有非极性键的是。
微粒2311Na+ 中的质子数是____,中子数是____,核外电子数是______。
烃A的分子式为C3H8,B、C是A的一氯代物,A~I有如下转化关系: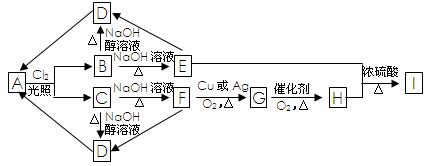
请回答下列问题:
(1)G的结构简式为。
(2)E→D的反应类型是反应。
(3)写出下列转化的化学方程式:
B→D
E+H→I
(4)H有多种同分异构体,写出满足下列两个条件的其中一种同分异构体的结构简式。
①分子结构中有烃基。②与新制的Cu(OH)2共热生成红色沉淀。