某实验小组对“载人宇宙飞船或潜水艇中一般都要安装盛放过氧化钠(Na2O2)颗粒的装置”感到非常好奇,设计实验进行探究。
【提出问题】过氧化钠是否为一种制氧剂?与人呼出的哪种气体发生反应?
【查阅资料】① 人呼出的气体中主要成分是N2、O2、CO2和水蒸气等。
② CO2 + 2NaOH=Na2CO3 + H2O。
【提出猜想】过氧化钠与人呼出的N2或CO2或水蒸气反应并生成氧气。
【进行实验】
实验Ⅰ:验证过氧化钠与氮气反应并生成氧气。
(1)实验操作如右图所示。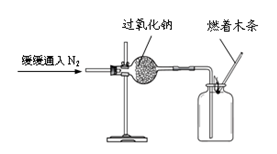
(2)实验现象及结论:观察到________现象,
判断过氧化钠与氮气没有发生反应。
实验Ⅱ:验证过氧化钠与水蒸气反应并生成氧气。
(1)同学们在老师的指导下设计了如下图所示装置。其中A装置的作用是_______,发生的变化是________变化。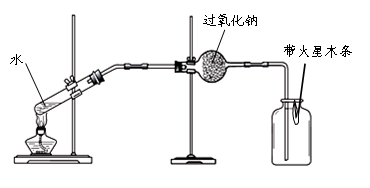
A B C
(2)实验现象及结论:带火星的木条复燃;过氧化钠与水蒸气发生反应并生成氧气。
实验Ⅲ:验证过氧化钠与二氧化碳反应并生成氧气。
(1)同学们在老师的指导下设计了如下图所示装置。(提示:C装置中的氢氧化钠溶液用于吸收可能未反应的二氧化碳)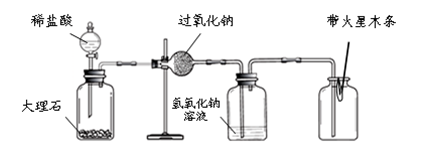
A B C D
(2)实验记录
| 实验操作 |
主要实验现象 |
实验结论及解释 |
|
| ① |
检查装置的气密性。 向装置中加入药品。 |
|
装置的气密性良好。 |
| ② |
打开分液漏斗活塞,向A装置中缓慢加入稀盐酸。 |
A装置中观察到的现象有________,C装置中有气泡出现。 |
A装置中发生反应的化学方程式为________; |
| ③ |
一段时间后用带火星的木条在D内进行检验。 |
带火星的木条复燃。 |
过氧化钠与二氧化碳反应并生成氧气。 |
【实验反思】
(1)根据实验Ⅱ和Ⅲ,过氧化钠与二氧化碳或水蒸气反应后,还产生了另一种物质,该物质是_______ _(填“单质”或“化合物”)。
(2)某同学对实验Ⅲ的设计提出疑问:该实验不能证明二氧化碳与过氧化钠确实发生了反应,你认为他的理由是______ __。
海洋是巨大的资源宝库,其中含有80多种元素。可以从海水中提取食盐,也可以从海水中提取用途广泛的金属镁,其制取工艺流程如下: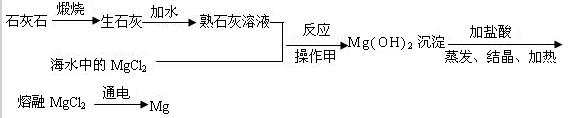
(1)从海水中提取食盐,是利用日光和风力使水分,得到食盐。
(2)要将Mg(OH)2沉淀分离出来,进行的操作甲的名称是,如果在学校实验室中完成该实验,要用到玻璃棒,其作用是,该操作中还需要的玻璃仪器是和。
(3)小明学习化学后知道,镁在氧气中燃烧会生成白色的氧化镁固体。但他在空气中点燃镁条时,却发现在生成的白色固体中还夹杂着少量的淡黄色固体。
[提出问题]为什么会生成淡黄色固体?
[查阅资料]小明查阅资料,记录了下列几种物质的颜色: 其他同学认为不必查阅氯化镁的颜色,理由是;
其他同学认为不必查阅氯化镁的颜色,理由是;
[提出猜想]分析资料,小明认为淡黄色固体可能是由镁与空气中的反应生成的;
[实验探究]小明设计实验证实了自己的猜想,他的方案可能是;
[实验结论]根据小明的实验结果,写出镁条在空气中燃烧时两个反应的化学方程式:、
[反思与评价]通过上述实验,你对燃烧有什么新的认识?。
[知识拓展]由上述实验结果,若有12g镁在空气中完全燃烧,则所得产物的总质量m 20g (填:“>”、“=”或“<”)。
某兴趣小组利用下列装置进行实验(装置B中仪器R是分液漏斗,可以调节活塞控制液体的滴加速度),请回答:
(1)分解过氧化氢制取氧气应选用的发生装置是(填序号),其化学方程式
为
(2)分解过氧化氢制得的氧气常带有少量水蒸气,欲收集一瓶干燥的氧气,气体从发生装置出来后,经过的导气管口正确的连接顺序是()()()()()
(3)若B装置中装有石灰石和稀盐酸,则该装置可用于制取_________气体。收集该气体时通常用法。制这种气体的化学方程式是。
(4)若用加热氯酸钾的方法制取氧气,常要加入二氧化锰做剂,应选用的发生
装置是,其化学方程式为 ;若用
加热高锰酸钾的方法制取氧气,需在试管口放。
小明通过有关资料得知在宇宙飞船上可以安装盛有Na2O2(过氧化钠)的装置,它的作用是与人呼出的二氧化碳反应生成氧气。于是他进行以下的探究活动: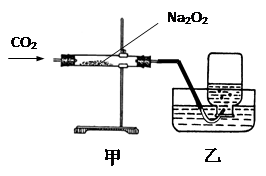
(1)他用右图装置制取并收集一瓶氧气,为检验收集到的氧气中是否含有二氧化碳,他应向集气瓶中滴入,振荡,发现,证明他收集到的氧气中还含有CO2。为使他能收集到一瓶较为纯净的氧气,你认为他应在甲、乙装置中间再连接以下的哪个装置?。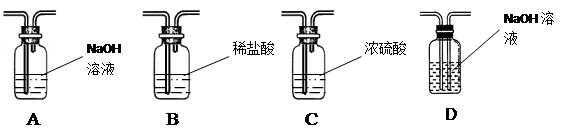
(2)进一步探究反应后玻璃管中剩余白色固体的成分。
【进行猜想】提出两个猜想:猜想①:白色固体含有过氧化钠;猜想②:白色固体含碳酸钠。
【查阅资料】过氧化钠为白色粉末,溶于水生成氢氧化钠和氧气。
【实验探究】下面是对白色固体进行实验探究的实验报告,请填写表中空白。
| 实验目的 |
操作方法 |
实验现象 |
实验结论 |
| 检验白色固体是否含有过氧化钠。 |
1、取该少量白色固体于试管里,加入适量的水; 2、用带火星的木条放在试管口。 |
1、; 2、。 |
白色固体加入水后有生成,白色固体含过氧化钠。 |
。 |
取该少量白色固体于试管里,向试管中滴。 |
。 |
白色物质中含有碳酸钠。 |
【实验反思】①过氧化钠与二氧化碳反应的化学方程式是:。
②过氧化钠常用于潜水艇、宇宙飞船上制取氧气的优点是(答2点),。
某化学兴趣小组根据下图所示装置进行实验室制取气体的探究。
回答下列问题:
(1)写出图中编号仪器名称:a,b;在实验时,若发现酒精灯里有足够的酒精,却不能点燃,其可能原因是。
(2)用高锰酸钾制氧气的化学方程式为,用C和D装置进行实验时,发现水槽中的水变成紫红色,原因是。
(3)若用石灰石和稀盐酸制取和收集干燥的二氧化碳,应选择的装置组合(填字母),制取二氧化碳的化学方程式为。
(4)右图装置可用来测量生成的CO2气体的体积,其中在水面上放一层植物油的目的是,植物油上方原有的空气对实验的结果(填“有”或“没有”)明显影响。
(5)由(2)(3)可得出:C装置适合于反应制取气体的实验,A、B装置适合于反应制取气体的实验。(填序号)
固体②固体和固体加热③固体和液体不需加热
小红发现松软的面包、酥脆的饼干内部都有许多小孔(如图所示)。为探究这个问题,她从面点师那里了解到:此类食品制作过程中加入膨松剂,碳酸氢钠就是一种常用的膨松剂。小红从超市买来一袋膨松剂(碳酸氢钠),按照研究物质的一般方法,对其进行探究。
①阅读使用说明:一使用时与面粉混合均匀,加水拌和,成型后直接焙制;
②观察到样品为白色粉末状物质;
③取少量样品加入水,发现其完全溶解;
④用pH试纸测溶液的酸碱度 pH=11;
⑤取少量样品,向其中加人稀盐酸,产生大量气泡;
⑥取适量样品放人试管加热,产生可以使澄清石灰水变浑浊的气体。
(l)请你通过以上实验判断,碳酸氢钠的水溶液显性,使面包、饼干形成小孔的气体应该是,你猜测产生这种气体的原因有。
(2)将少许面粉加人水中 取上层液用pH试纸测量,显中性,由此你认为碳酸氢钠能使食品膨松的主要原因是。
(3)请你通过以上探究活动,总结碳酸氢钠的物理性质。
(4)请写出你所了解的碳酸氢钠的其它两个用途。