(6分)已知A、B、C、D分别是AlCl3、BaCl2、FeSO4、NaOH四种化合物中的一种,它们的水溶液之间的一些反应现象如下:
① A + B→白色沉淀,加入稀硝酸,沉淀不溶解
② B + D→白色沉淀,在空气中放置,沉淀由白色转化为红褐色
③ C + D→白色沉淀,继续加入D溶液,白色沉淀逐渐消失
⑴试推断A B C D (化学式)。
⑵写出下列反应的化学方程式或离子方程式:
①实验②中沉淀由白色转化为红褐色的化学方程式 ,
②C溶液与D溶液反应后生成的白色沉淀溶解于D溶液中的离子方程式 。
氧化还原是常见的反应类型,根据信息回答以下问题:
1、A图是“四种基本反应类型与氧化还原反应的关系”图,请在A图中用阴影部分表示反应:Cl2 + 2NaBr —→ 2NaCl + Br2 所属的区域。
2、“四种基本反应类型与氧化还原反应的关系”也可用B图表达。①其中Ⅰ为化合反应,则Ⅱ为 反应。②写出一个有水生成的符合反应类型Ⅲ的化学方程式:。③写出一个有水参加的符合反应类型Ⅳ的化学方程式,
其中水作为剂。(填氧化剂、还原剂等)
3、用“单线桥”分析下列氧化还原反应的电子转移方向及数目,并填空。
(1)2HClO —光→ 2HCl + O2↑氧化产物被还原的元素
(2)2NaCl + 2H2O —电解→ 2NaOH + Cl2↑ + H2↑
4、有F-、Cl-、I-、Br2、I2五种粒子,其中氧化性最强的是,还原性最强的是,用离子方程式表示氧化性强弱的事实:
。
在汽车上安装三效催化转化器,可使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染。
(1)已知:N2(g)+ O2(g)="2NO(g)" △H="+180.5" kJ·mol-1
2C(s)+ O2(g)="2CO(g)" △H=-221.0 kJ·mol-1
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ·mol-1
①尾气转化的反应之一:2NO(g)+2CO(g)=N2(g)+2CO2(g)△H=。
②已知:N2、O2分子中化学键的键能分别是946 kJ·mol—1、497 kJ·mol—1,则NO分子中化学键的键能为 kJ·mol—1。
(2)某研究性学习小组在技术人员的指导下,在某温度时,按下列流程探究某种催化剂作用下的反应速率,用气体传感器测得不同时间的NO和CO浓度如表: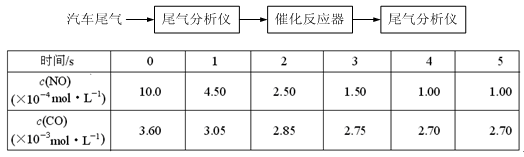
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
①前3s内的平均反应速率v (N2) = _________________________。
②在该温度下,反应的平衡常数K = 。(只写出计算结果)
③该可逆反应△S0(填“>”、“<”或“=”),在_______________(填“高温”、“低温”或“任何温度”)下能自发进行。
(3)CO分析仪以燃料电池为工作原理,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法错误的是
| A.负极的电极反应式为: CO+O2—―2e-=CO2 |
| B.工作时电极b作正极,O2-由电极a流向电极b |
| C.工作时电子由电极a通过传感器流向电极b |
| D.传感器中通过的电流越大,尾气中CO的含量越高 |
甲、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系。
甲 + H2O → 丙 + 丁
(1)转化关系中所涉及的反应为非氧化还原反应。
①若甲是一种钠盐,丁为两性氢氧化物,则甲的化学式为,丁的酸式电离方程式为。
②若甲是由N和Cl元素组成的化合物,其分子结构模型如右图所示,丙具有漂白性。则甲中Cl元素的化合价是 ,丁与H2O有相同的电子总数,则丁的电子式为
(2)转化关系中所涉及的反应为氧化还原反应。
①若甲和丙是同主族元素组成的单质,且组成甲的元素位于第三周期,此反应的离子方程式是。
②若丙和丁都可在一定条件下还原CuO,此反应的化学方程式是。
A、B、C、D、E五种短周期元素,它们的原子序数依次增大。B原子的最外层电子数是其次外层电子数的2倍;A的一种原子中,质量数与质子数之差为零。D元素的原子最外层电子数为m,次外层电子数为n;E元素的原子L层电子数为m+n,M层电子数为 。请回答下列问题:
。请回答下列问题:
(1)B元素是____________,D元素在周期表中的位置是_____________________;
(2)C与E形成的化合物E3C属于________晶体(填“原子”、“离子”或“分子”);
(3)由A、D、E元素组成的化合物中存在的作用力是_________________________;
(4)写出一个E和D形成的化合物与水反应的化学方程式_______________________;
(5)C的最高价氧化物对应的水化物与其氢化物反应生成一种盐X,X的水溶液显________性(填“酸”、“碱”或“中”),其原因用离子方程式表示:___________
__________________________。
(8分)A、B、C、D四种物质之间有下图所示的转化关系。已知:A是一种非金属单质,为黄色晶体;B、C、D均为化合物;B是形成酸雨的主要成分之一。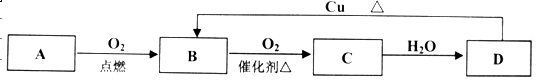
请回答下列问题:
(1)化合物B是 (填化学式,下同),化合物D是 ;
(2)B→C化学反应的类型是 反应(填“化合”、“分解”、“置换”或“复分解”)
(3)向D的稀溶液中滴加BaCl2溶液,能产生白色沉淀。写出该反应的离子方程式:
________________________________________ __________。