将一定质量的Mg和Al的混合物投入2.0 mol/L,250 mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入一定浓度的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。回答下列问题:
(1)由图可知加入镁的物质的量是 _____________________。
(2)当加入NaOH溶液的体积小于20mL时发生的离子反应是__________,当加入NaOH溶液的体积大于200 mL时发生的离子反应是______________。
(3)NaOH溶液的物质的量浓度为______________________。
进行胃部透视时,常在检查之前服用“钡餐”,其主要成分是硫酸钡。
(1)25℃时,已知胃液的pH在0.9—1.5之间,请问__。(填“能”或“不能”)用碳酸钡代替硫酸钡作为“钡餐”使用,简述你做出判断的理由(用有关离子方程式解释)_。
(2)当人体中Ba2+ 浓度达到2×10-3mol·L-1时,就会对健康产生危害,若误将氯化钡当做食盐食用,请计算说明是否 可以通过服用大量5%的硫酸钠溶液(约0.36mol·L-1)有效除去胃中的Ba2+。(25℃时,硫酸钡的溶度积常数Ksp=1.1×10-10)
可以通过服用大量5%的硫酸钠溶液(约0.36mol·L-1)有效除去胃中的Ba2+。(25℃时,硫酸钡的溶度积常数Ksp=1.1×10-10)
。 (3)环境监测某工厂废水中Ba2+的浓度。取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉
(3)环境监测某工厂废水中Ba2+的浓度。取废水50.00mL,控制适当的酸度加入足量的K2Cr2O7溶液,得BaCrO4沉淀;沉 淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-,再加入过量KI溶液,反应液中再滴加0.100mol·L-1Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为:
淀经洗涤、过滤后,用适量的稀盐酸溶解,此时CrO42-全部转化为Cr2O72-,再加入过量KI溶液,反应液中再滴加0.100mol·L-1Na2S2O3溶液,反应完全时,消耗Na2S2O3溶液36.00mL。已知有关的离子方程式为:
① Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O;② I2+2S2O32-=2I-+S4O62-。
试计算该工厂废水中Ba2+的物质的量浓度。
(1)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化 学方程式。
学方程式。
________ + ________ → ________ + ________ + ________ + H2O
(2)反应物中发生氧化反应的物质__________,被还原的元素是_________。
(3)反应中1mol氧化剂_______(填“得到”或“失去”)________mol电子。
(4)请将反应物的化学式及配平后的系数填入下列相应的位置中: __________+
__________+ __________→
__________→
某强碱性溶液中可能含有的离子是K+、NH4+、Al3+、AlO2-、SO42-、SiO32-、CO32-、Cl-中的某几种离子 ,现进行如下实
,现进行如下实 验:
验:
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成。
②另取少量溶液逐滴加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失。
(1)原溶 液中肯定存在的离子是_________________,肯定不存在的离子是_____________。
液中肯定存在的离子是_________________,肯定不存在的离子是_____________。
(2)已知一定量的原溶液中加入5mL 0.2mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187g,则原溶液中是否含有Cl-?______________。
(3)按照反应顺序 逐步书写出②中发生反应的离子反应方程式
逐步书写出②中发生反应的离子反应方程式
① H++OH-=H2O②_____________ _____
③__________________④ HCO3-+H+=H2O+CO2↑
⑤___________ _______
有机物X是有机合成工业中一种重要的中间体。1mol有机物A发生银镜反应产生4molAg。X可以由有机物A经过一系列反应制得,也可由另一种有机物Y在一定条件下制得。合成路径如下图所示:
②Y分子中C、H、O(不含其它元素)的个数比为1:1:1,且Y的相对分子质量的范围在80-160之间。
③Y是一种二元酸,且能使Br2/CCl4褪色。
④E和X中都含有五元环。
请回答以下问题:
(1)请指出反应类型:反应②______________,反应⑤_____________。
(2)Y的分子式为_______________;X的结构简式为_______________。
(3)反应①和②的顺序不能调换,请简述理由__________________________________。
(4)化合物D在浓H2SO4催化作用下能生成一种高分子化合物,请写出该反应方程式
______________________________________________________。
(5)化合物D有许多同分异构体,其中同分异构体D1和D2都满足以下条件:分子中含有酯基结构,且D1和D2都是二元酸。请写出D1、D2的结构简式:_____________,
_____________。
(14分)硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3 、FeCO3MgO、CaO等,生产工艺流程示意如下: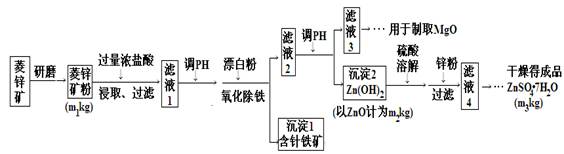
(1)将菱锌矿研磨成粉的目的是。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+□____+□_____==□Fe(OH)3 +□Cl-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,相对分子质量为89,化学式是______。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______。
| Mg(OH)2 |
Zn(OH)2 |
MgCO3 |
CaCO3 |
|
| 开始沉淀的pH |
10.4 |
6.4 |
— |
— |
| 沉淀完全的pH |
12.4 |
8.0 |
— |
— |
| 开始溶解的pH |
— |
10.5 |
— |
— |
| Ksp |
5.6×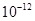 |
— |
6.8×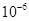 |
2.8×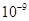 |
(5)工业上从“滤液3”制取MgO过程中,最合适的反应物是______(选填序号)。
a.大理石粉b.石灰乳c.纯碱溶液d.烧碱溶液
(6)“滤液4”之后的操作依次为______、______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________。