在溶液中有浓度均为0.01mol/L的Fe3+、Cr3+、Zn2+、Mg2+等离子,已知:Ksp[Fe(OH)3]=2.6×10-39;Ksp[Cr(OH)3]=7.0×10-31;Ksp[Zn(OH)2]=1.0×10-17;Ksp[Mg(OH)2]=1.8×10-11,当其氢氧化物刚开始沉淀时,下列哪一种离子所需的pH最小
| A.Zn2+ | B.Cr3+ | C.Fe3+ | D.Mg2+ |
下列说法中正确的一组是
| A.H2和D2互为同位素; |
B.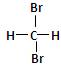 和 和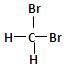 互为同分异构体; 互为同分异构体; |
C.碳链为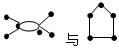 的烃为同系物 的烃为同系物 |
| D.金刚石、石墨和“足球烯”C60为同素异形体 |
防治禽流感病毒目前人类面临的一个重大课题。八角茴香属于草本植物,是我国民间常用做烹调的香料。医学研究成果显示,从八角茴香中可提取到莽草酸,莽草酸有抗炎、镇痛作用,也是合成对禽流感病毒有一定抑制作用的一种药物“达菲”的前体。莽草酸的结构式如下图所示,下列关于莽草酸的说法正确的是
| A.莽草酸的分子式为C7H4O5 | B.莽草酸的分子之间可能发生酯化反应 |
| C.莽草酸中含有苯环 | D.莽草酸不能使溴水褪色 |
鲨鱼是世界上惟一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌性。已知鲨烯分子含有30个C原子及6个C=C且不含环状结构,则其分子式为
| A.C30H60 | B.C30H56 | C.C30H52 | D.C30H50 |
鉴别淀粉、蛋白质、葡萄糖水溶液,依次可分别使用的试剂和对应的现象正确的是
| A.碘水,变蓝色;浓硝酸,变黄色;新制Cu(OH)2悬浊液,砖红色沉淀 |
B.浓硝酸,变黄色;新制Cu(OH)2悬浊液,砖红色沉淀;碘水,变蓝色 |
C.新制Cu(OH)2悬浊液,砖红色沉淀;碘水,变蓝色;浓硝酸,变黄色 |
| D.碘水,变蓝色;新制Cu(OH)2悬浊液,砖红色沉淀;浓硝酸,变黄色 |
丙烯酸(CH2=CH-COOH)的性质可能有:①加成反应②水解反应③酯化反应④中和反应⑤加聚反应
| A.只有①③ | B.只有①③④ | C.只有①③④⑤ | D.①②③④⑤ |