已知有关物质的熔、沸点数据如表:
| 物质 |
MgO |
Al2O3 |
MgCl2 |
AlCl3 |
| 熔点/℃ |
2 852 |
2 072 |
714 |
190(2.5×105 Pa) |
| 沸点/℃ |
3 600 |
2 980 |
1 412 |
182.7 |
请参考上述数据填空和完成问题:
(1)工业上常用电解熔融MgCl2的方法生产金属镁,电解Al2O3与冰晶石熔融混合物的方法生产铝。为什么不用电解MgO的方法生产镁,也不用电解AlCl3的方法生产铝?______________________________。
(2)设计可靠的实验证明MgCl2、AlCl3所属的晶体类型,其实验方法是_______________。
慢心律是一种治疗心律失常的药物,它的合成路线如下: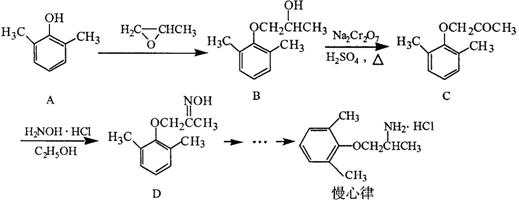
(1)由B → C的反应类型为。
(2)B分子中有2个含氧官能团,分别为和(填官能团名称)。
(3)写出A与浓溴水反应的化学方程式。
(4)写出同时满足下列条件的D的一种同分异构体的结构简式:。
①属于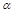 -氨基酸;
-氨基酸;
②是苯的衍生物,且苯环上的一氯代物只有一种。
(5)已知乙烯在催化剂作用下与氧气反应可以生成环氧乙烷。
完成以邻甲基苯酚(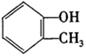 )和乙醇为原料制备
)和乙醇为原料制备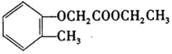 的合成路线流程图。
的合成路线流程图。
①结合题中信息;无机试剂任用。
②合成路线流程图中,在( )填反应条件,在[ ]填反应物或生成物的结构简式: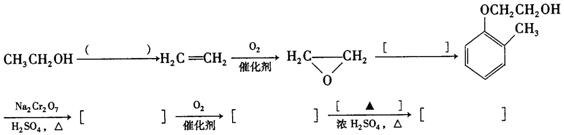
烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液,并用于烟气脱硫研究。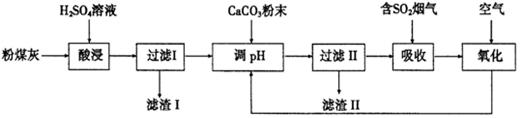
(1)酸浸时反应的化学方程式为;滤渣I的主要成分为(填化学式)。
(2)滤渣Ⅱ的主要成分为(填化学式);制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液的化学方程式为。
(3)吸收烟气中SO2的化学方程式为Al2(SO4)3·Al2O3+3SO2 = Al(SO4)3·Al2(SO3)3。通入空气氧化,发生反应的化学方程式为;氧化后循环利用的溶液的pH将(填“增大”、“减小”或“不变”)。
已知:硫酸铜溶液中滴入氨基乙酸钠(H2N-CH2-COONa)即可得到配合物A。其结构如下图:
(1)Cu元素基态原子的外围电子排布式为。
(2)元素C、N、O的第一电离能由大到小排列顺序为。
(3)配合物A中碳原子的轨道杂化类型为。
(4)1mol氨基乙酸钠(H2N-CH2-COONa)含有 键的数目为。
键的数目为。
(5)氨基乙酸钠分解产物之一为二氧化碳。写出二氧化碳的一种等电子体:(写化学式)。
(6)已知:硫酸铜灼烧可以生成一种红色晶体,其结构如图,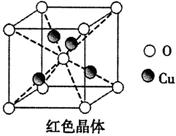
则该化合物的化学式是。
二甲醚(CH3OCH3)是一种清洁、高效、具有优良的环保性能的可燃物,被称为21世纪的新型能。工业制备二甲醚的生产流程如下:
催化反应室中(压力2.0~10.0MPa,温度300℃)进行下列反应:
①CO(g)+2H2(g) CH3OH(g)△H 1=" -" 90.7 kJ·mol-1
CH3OH(g)△H 1=" -" 90.7 kJ·mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2 =" -" 23.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2 =" -" 23.5 kJ·mol-1
③CO(g)+H2O(g) CO2(g)+H2(g)△H3 =" -" 41.2 kJ·mol-1
CO2(g)+H2(g)△H3 =" -" 41.2 kJ·mol-1
(1)催化反应室中的总反应:3CO(g)+3H2(g)  CH3OCH3(g)+CO2(g)。
CH3OCH3(g)+CO2(g)。
该反应的反应热△H =_________。催化反应室中采用300℃的反应温度,理由是。
(2)已知:反应①在300℃时的化学平衡常数为0.27。该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将(填“正向进行”、“逆向进行”或“处于平衡状态”)。
(3)上述流程中二甲醚精制的实验操作名称为。
(4)图为绿色电“二甲醚燃料电池”的工作原理示意图。
该电池工作时,H+向极移动(填“正”或“负”);a电极的电极反应式为。
某科研小组设计出利用工业废酸(稀H2SO4)浸取某废弃的氧化铜锌矿的方案,实现废物综合利用,方案如下图所示。
已知:各离子开始沉淀及完全沉淀时的pH如下表所示。
| 离子 |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe2+ |
6.34 |
9.7 |
| Fe3+ |
1.48 |
3.2 |
| Zn2+ |
6.2 |
8.0 |
请回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是。
(2)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS)Ksp(ZnS)(选填“>”“<”或“=”)。
(3)物质A最好使用下列物质中的。
A.KMnO4 B.空气 C.HNO3 D.NaClO
(4)除铁过程中加入氨水的目的是调节溶液的pH,pH应控制在范围之间。
(5)物质B可直接用作氮肥,则B的化学式是。
(6)除铁后得到的Fe(OH)3可用KClO溶液在碱性环境将其氧化得到一种高效的多功能水处理剂——K2FeO4,写出该反应的离子方程式。