有下列八种晶体:
| A.水晶 | B.冰醋酸 | C.氧化镁 | D.白磷 E.晶体氩 F.氯化铵 G.过氧化钾 H.金刚石 |
(1)属于原子晶体的化合物是__________,直接由原子构成的晶体是__________,直接由原子构成的分子晶体是__________。
(2)由极性分子构成的晶体是__________,含有共价键的离子晶体是__________,属于分子晶体的单质是__________。
(3)受热熔化后化学键不发生变化的是__________,需克服共价键的是__________。
漂白粉在 生活、工业生产中用途广泛,漂白粉除了具有漂白作用外,还能杀菌消毒。2003年抗“非典”期间,各商场漂白粉及其他漂白产品曾一度脱销。
生活、工业生产中用途广泛,漂白粉除了具有漂白作用外,还能杀菌消毒。2003年抗“非典”期间,各商场漂白粉及其他漂白产品曾一度脱销。
(1)用Cl2和石灰乳制作漂白粉的反应方程式
其成分是有效成分是(填名称)
(2)用Cl2和石灰乳制作漂白粉的目的是()
| A.转变为较HClO稳定且易储运的物质 |
| B.转变为更易溶于水的物质 |
| C.提高氯气原利用率 |
| D.增强漂白能力 |
(3)瓶装漂白粉久置空气中会失效。用化学方程式表示漂白粉在空气中易失效的原因:
①
②
常温下,取0.1 mol/L HA溶液与0.1 mol/L NaOH溶液等体积混合(混合后溶液体积的变化不计),测得混合溶液的pH=8。试回答以下问题:
(1)混合后溶液的pH=8的原因是____________________________(用离子方程式表示)。
(2)混合后的溶液中由水电离出的c(OH-)____0.1 mol/L NaOH溶液中由水电离出的c(OH-) (填“>”、“<”或“=”)。
(3)已知NH4A溶液为中性,又知将HA溶液加到NaHCO3溶液中有气体放出,试推断NH4HCO3溶液的pH________7(填“>”、“<”或“=”)。
(4)有相同温度下相同浓度的四种盐溶液:
| A.NH4HCO3; | B.NH4A; | C.(NH4)2SO4; | D.NH4Cl,按pH由大到小的顺序排列________(填序号)。 |
氮是地球上含量丰富的一种元素,氮元素的
单质及其化合物在工农业生产、生活中有着重要作用。
(1)根据右侧能量变化示意图,请写出NO2和CO反应
的热化学方程式。
(2)在固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g) 2NH3(g) △H < 0,
2NH3(g) △H < 0,
其平衡常数K与温度T的关系如下表:
| T/K |
298 |
398 |
498 |
| 平衡常数K |
4.1×106 |
K1 |
K2 |
①该反应的平衡常数表达式:K=
②试判断K1K2(填写“>”,“=”或“<”)
③下列各项能说明该反应已达到平衡状态的是 (填字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正 = 3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)对反应N2O4(g) 2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是。
2NO2(g) △H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是。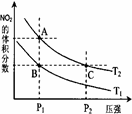
a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法
(4)一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则N2的转化率a(N2)=, 以NH3表示该过程的反应速率v(NH3)= 。
(12分)
(1)实验室在临时配制一些FeCl2的溶液时,常将氯化亚铁固体先溶于较浓的盐酸中,然后再用蒸馏水稀释到所需的浓度,是为了。稀释后还需要加入一些铁粉,其目的是,相关反应的离子方程式为。
(2)氯化铁水溶液呈性 ,原因是(用离子方程式表示):
_________________________ 。把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是。如果要从氯化铁溶液得到纯氯化铁固体,常采用的方法是。
在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力如右图所示。请回答: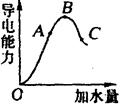
(1)“O”点导电能力为“0”的理由是
。
(2)A、B、C三点pH由大到小的顺序是__________________。
(3)A、B、C三点电离度最大的是_____________。