A~F是中学化学中常见物质,常温下A、C、E、F为气体,B、D为液体,其中B的分子为4原子分子,D在常温下不具有挥发性。F的浓溶液与X共热通常用于实验室制备单质C,
X是一种黑色粉末。这些物质之间满足如下图所示的转化关系,图中部分生成物已略去。
(1)写出下列物质的化学式:A______,F______。
(2)B的电子式是______。根据图中信息,B、C、X的氧化性由强到弱的顺序是_ _____
(用化学式表示)。
(3)反应⑥的离子方程式是__ ____。
(4)在反应⑥中,F表现的性质是___ ____,当生成0.75mol C时,被氧化的还原剂
的物质的量是___ ____。
(一)铝是生活中非常常见的一种金属,运用所学知识回答:
(1)金属铝是活泼的金属,但在生活中应用很广泛,原因是。
(2)铝盐或铁盐能用于净水,是因为铝盐或铁盐在水溶液中形成了。
(3)铝粉与氧化铁粉末在高温下得到铁的反应叫做“铝热反应”,发生反应的化学方程式为。
(二)有一种褐铁矿主要成分是Fe2O3,所含杂质不溶于水和酸。某研究性学习小组的同学们利用一小块样品,设计实验证明矿物样品中有Fe3+。
实验用品:研钵、烧杯、玻璃棒、漏斗、铁架台、滤纸、试管、胶头滴管
(4)简述实验操作步骤、现象和结论。
(7分) 铜和浓硫酸发生反应的化学方程式为:
Cu +2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(1)浓H2SO4作_________剂,具有性。
(2)在该反应中,若消耗了32 g Cu,则转移了_______mol 电子 ,还原了mol H2SO4,生成L SO2(标准状况)气体。
(3)以下三种物质的氧化性由强到弱的顺序为:(写出序号)
① 浓H2SO4②稀H2SO4③CuSO4
(1)写出下列反应的离子方程式:
①用氯化铁溶液蚀刻印刷铜电路板
②过量二氧化碳通入澄清石灰水
③氯化铝溶液与足量的氨水反应
(2)写出下列反应的化学方程式:
①铁与水反应
②氧化铝与氢氧化钠溶液反应
③碳酸钠转化为碳酸氢钠的反应
下表是甲城市某日空气质量报告:
| 城市 |
污染指数 |
首要污染物 |
空气质量级别 |
空气质量状况 |
| 甲 |
55 |
SO2 |
II |
良 |
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行探究。
【探究实验】实验一:用下图所示装置进行实验。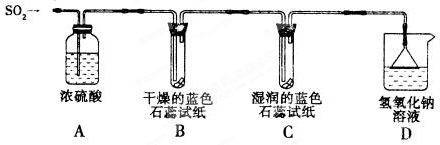
①A装置的作用是(填“干燥”或“氧化”)SO2气体。
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸
变色,说明SO2与水反应生成一种酸,该酸的化学式是。
③D装置的作用是。若实验中向装置内通入标准状况下1.12L SO2气体,且NaOH溶液过量。最多能生成Na2SO3的物质的量为mol。(反应的化学方程式为:SO2+2NaOH=Na2SO3+H2O)
实验二:往盛有水的烧杯中通入SO2气体,测得所得溶液的pH7(填“>”、“=”或“<”=,然后每隔1 h测定其pH,发现pH逐渐变小,直至恒定。说明烧杯中溶液被空气中的氧气氧化最终生成H2SO4。
【查阅资料】SO2形成酸雨的另一途径; SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4。在此过程中飘尘作催化剂。
【探究结论】SO2与空气中的氧气、水反应生成硫酸而形成酸雨。本市可能易出现酸雨。
【知识联想】
(1)酸雨造成的危害是:(举一例)。
(2)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为,是造成酸雨的另一主要原因。
【提出建议】本市汽车数量剧增,为了减少汽车尾气造成的污染,建议市政府推广使用混合型汽油,即往汽油中按一定比例加人(填“水”或“乙醇”)。
(4分)为了达到下表所列的一些有关家庭常用物质的实验要求,请选择合适的化学试剂,将其标号填入对应的空格中。
| 实验要求 |
化学试剂 |
| 检验酒精中是否有水 |
|
| 验证味精是否有食盐 |
|
| 除烧水壶中的水垢(主要成分CaCO3、Mg(OH)2) |
|
| 证明地瓜粉中含有淀粉 |
|
供选择的化学试剂
A.醋酸 B.硝酸银溶液和硝酸 C.碘水 D.无水硫酸铜粉末