短周期元素X、Y可以形成化合物XY2,下列有关叙述不正确的是( )
| A.若XY2是共价化合物,则X与Y的原子序数可能相差1 |
| B.若XY2是离子化合物,则X与Y的原子序数可能相差8 |
| C.若X与Y的原子序数相差5,则离子化合物XY2中X的离子半径比Y离子半径小 |
| D.若X与Y的原子序数相差6,则共价化合物XY2可溶于强碱溶液 |
如图装置中,小试管内为红墨水,带有支管的U型管中盛有pH=4的雨水和生铁片。经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释合理的是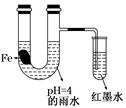
| A.生铁片中的碳是原电池的负极,发生还原反应 |
| B.雨水酸性较强,生铁片始终发生析氢腐蚀 |
| C.墨水液面回升时,正极反应式为:O2+2H2O+4e-===4OH- |
| D.U型管中溶液pH逐渐减小 |
9.下列各组物质的变化,不能用勒夏特列原理解释的是
A.新制的氯水在光照条件下颜色变浅
B.NO2和N2O4的混合体系,增大压强(压缩体积),颜色变深
C. 工业生产硫酸的过程中使用过量的O2,以提高SO2的转化率
实验室用Zn与稀H2SO4反应来制取氢气,常加少量CuSO4来加快反应速率。为了研究CuSO4的量对H2生成速率的影响,某同学用实验比较法设计了如下实验方案,将表中所给的试剂按一定体积混合后,分别加入四个盛有相同大小的Zn片(过量)的反应瓶(甲、乙、丙、丁)中,收集产生的气体,并记录收集相同体积的气体所需的时间。
| 实验 试剂 |
甲 |
乙 |
丙 |
丁 |
| 4 mol·L-1H2SO4/mL |
20 |
V1 |
V2 |
V3 |
| 饱和CuSO4溶液/mL |
0 |
2.5 |
V4 |
10 |
| H2O/mL |
V5 |
V6 |
8 |
0 |
| 收集气体所需时间/s |
t1 |
t2 |
t3 |
t4 |
下列说法正确的是
A.t1 < t2 < t3 < t4 B.V4=V5=10 C.V6=7.5 D.V1<V2<V3<20
氯化铜的稀溶液是淡蓝色的,加入浓盐酸后,溶液变成黄绿色了,这种颜色变化是由下列可逆反应造成的:Cu(H2O)42+(溶液)+4Cl-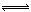 CuCl42-(溶液)+4H2O,其中Cu(H2O)42+为淡蓝色,CuCl42-为黄绿色。下列方法①加蒸馏水,②加AgNO3固体,③加入NaCl固体,④加入过量NaOH溶液中,能使溶液变成淡蓝色的是:
CuCl42-(溶液)+4H2O,其中Cu(H2O)42+为淡蓝色,CuCl42-为黄绿色。下列方法①加蒸馏水,②加AgNO3固体,③加入NaCl固体,④加入过量NaOH溶液中,能使溶液变成淡蓝色的是:
| A.只有① | B.只有② | C.①和② | D.③和④ |
下列表述中正确的是
| A.任何能使熵值增大的过程都能自发进行 |
| B.增大反应物的量,一定会加快正反应速率,使平衡向正反应方向进行 |
| C.化学平衡发生移动,平衡常数不一定发生变化 |
| D.反应物的转化率减少,平衡一定向逆反应方向移动 |