A、B、C、D、E、F是五种短周期元素,它们的原子序数依次增大;A元素的原子是半径最小的原子;B元素的最高价氧化物对应水化物与其气态氢化物反应生成一种盐X;D与A同主族,且与F同周期;F元素的最外层电子数是其次外层电子数的3/4倍,A、B、D、F这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。D、E、F三种元素对应的最高价氧化物的水化物间两两皆能反应。请回答下列问题:
(1)写出B、C、E元素的名称B 、C 、E 。
(2)写出C、D两种元素形成的原子个数比为1:1的物质的电子式为 。
(3)可以验证C和F两种元素非金属性强弱的结论是(填编号)
①比较这两种元素常见单质的熔点
②比较这两种元素的单质与氢气化合的难易程度
③比较这两种元素的气态氢化物的还原性
(4)A、C、D、F四种元素可以形成两种酸式盐(均由四种元素组成),这两种酸式盐的化学式分别为 、 ,这两种酸式盐相互反应的离子方程式为 。
(5)A、C、F间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为
。
(6)向含有a mol E的氯化物的溶液中加入含b mol D的最高价氧化物对应水化物的溶液,生成沉淀的物质的量不可能为 。
①a mol ②b mol ③a/3 mol
④ b/3 mol ⑤0 ⑥(4a-b)mol
工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下: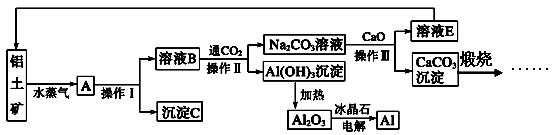
请回答下列问题:
(1)沉淀C的化学式为________,该物质用途除了用于金属冶炼以外,还可用作________。
(2)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有________(填化学式)。用此法制取铝的副产品是________(填化学式)。
(3)操作Ⅰ、操作Ⅱ和操作Ⅲ都是________(填操作名称),实验室要洗涤Al(OH)3沉淀应该在________装置中进行,洗涤方法是____________________________________
___________________________________________________________________。
(4)电解熔融的氧化铝时,若得到标准状况下22.4 L O2,则同时生成铝的质量为________。
(5)写出Na2CO3溶液与CaO反应的离子方程式:_______________________________。
汽油不仅是重要的燃料,而且是重要的化工原料。它既可以裂解得到气态化工原料如乙烯等,还可以在催化剂催化下改变分子结构,由链烃变成芳香烃,如已烷变成苯,庚烷变成甲苯,这个变化叫异构化。请根据以汽油为原料的下列衍变关系,回答下列问题: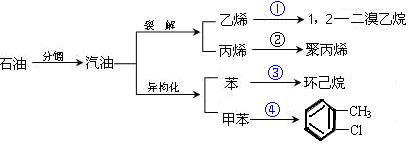
(1)写出反应②和③的化学方程式
________________________________;___________________________________
(2)①④的反应类型分别是_____________、_________________
(3)四氟乙烯(CF2=CF2)在一定条件下发生聚合反应,生成的聚四氟乙烯可做“不粘锅” 炊具的内涂层。下列叙述正确的是
| A.聚四氟乙烯中不含碳碳双键,在高温时容易燃烧 |
| B.聚四氟乙烯是高分子化合物 |
| C.聚四氟乙烯的化学性质很稳定,正常使用时几乎不会发生化学变化 |
| D.由于氟是最活泼的非金属元素,故四氟乙烯不会发生任何化学变化 |
E.取等质量的乙烯和聚乙烯,完全燃烧,生成的CO2和H2O的物质的量分别相等
F.四氟乙烯和聚四氟乙烯都属于纯净物
下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。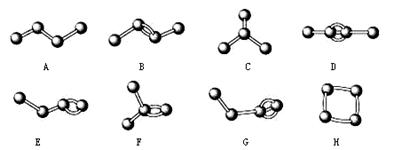
(1)图中与甲烷互为同系物的是(填编号)
(2)上图中互为同分异构体的是:B与;D与。(填编号)
[Ⅰ] 将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:
3A(g) +B(g) 2C(g)+2D(g),
反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用C表示10s 内正反应的化学反应速率为;
(2)反应前A的物质的量浓度是;
(3)平衡后,生成物D的浓度为;
[Ⅱ] 某温度下,在一个体积为2L的固定不变的密闭容器中充入0.3mol SO2和0.2mol O2,发生2 SO2+ O2 2 SO3反应。几分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90% ,则该反应达到平衡时SO2的转化率为______________。
2 SO3反应。几分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90% ,则该反应达到平衡时SO2的转化率为______________。
已知乳酸的结构简式为 。试回答:
。试回答:
(1)乳酸分子中含有________和_________两种官能团(写名称);
(2)乳酸与足量金属钠反应的化学方程式为
___________________________________________________________________;
(3)乳酸与Na2CO3溶液反应的化学方程式为
___________________________________________________________________;