下列四个反应可用H++OH-=H2O这个离子方程式表示的是( )
| A.Ba(OH)2溶液与稀硫酸 |
| B.Cu(OH)2与稀硫酸 |
| C.NaOH溶液与稀硫酸 |
| D.NH3•H2O与稀硫酸 |
药物贝诺酯可由乙酰水杨酸和对-乙酰氨基酚在一定条件下反应制得: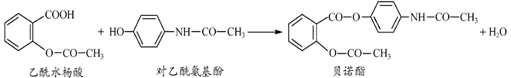
有关上述反应物和产物的叙述不正确的是
| A.上述三种有机物中共有四种含氧官能团 |
| B.贝诺酯分子中有9种不同化学环境的氢原子 |
| C.贝诺酯与足量NaOH(aq)共热,最多消耗NaOH 4mol |
| D.可用FeCl3(aq) 区别乙酰水杨酸和对-乙酰氨基酚 |
高氯酸、硫酸、硝酸和盐酸都是强酸,其酸性在水溶液中差别不大,以下是某温度下这四种酸在冰醋酸中的电离常数
| 酸 |
HClO4 |
H2SO4 |
HCl |
HNO3 |
| Ka] |
1.6×10-5 |
6.3×10-9 |
1.6×10-9 |
4.2×10-10 |
从以上表格中判断以下说法中不正确的是()
A.在冰醋酸中硫酸的电离方程式为H2SO4=2H++SO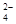
B.在冰醋酸中高氯酸是这四种酸中最强的酸
C.在冰醋酸中这四种酸都没有完全电离
D.水对于这四种酸的强弱没有区分能力,但醋酸可以区别这四种酸的强弱
为监测空气中汞蒸气是否超标,通过悬挂涂有CuI(白色)的滤纸,根据滤纸是否变色(亮黄色至暗红色)及变色所需时间来判断空气中的汞含量。发生的化学反应为:4CuI+Hg=Cu2HgI4+2Cu。下列说法不正确的是
| A.上述反应属于置换反应 | B.当有1 mol CuI反应时,转移电子为0.5 mol |
| C.该反应中的氧化剂为CuI | D.Cu2HgI4既是氧化产物又是还原产物 |
下列说法中不正确的是
A.在甲、乙两烧杯的溶液中,共含有Cu2+、K+、H+、Cl-、CO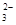 、OH-六种离子。已知甲烧杯的溶液含其中3种离子并呈蓝绿色,则乙烧杯的溶液中含有的3种离子是K+、OH-、CO 、OH-六种离子。已知甲烧杯的溶液含其中3种离子并呈蓝绿色,则乙烧杯的溶液中含有的3种离子是K+、OH-、CO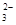 |
B.常温下pH=7的溶液中:Fe3+、Mg2+、SO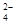 、Cl-能大量共存 、Cl-能大量共存 |
C.在含有HCO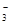 、SO 、SO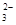 、S2-、CH3COO-四种阴离子的溶液中加入足量的BaO2固体后,CH3COO-浓度变化最小 、S2-、CH3COO-四种阴离子的溶液中加入足量的BaO2固体后,CH3COO-浓度变化最小 |
D.常温下水电离出c(H+)·c(OH-)=10-20的溶液中:Na+、ClO-、S2-、NH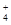 不能大量共存 不能大量共存 |
常温下,关于下列各溶液的叙述正确的是
| A.pH>7的醋酸钠和醋酸的混合溶液中:c(CH3COO-)>c(Na+) |
| B.0.1mol/L稀醋酸pH=a,0.01mol/L的稀醋酸pH=b,则a+1=b |
| C.0.1mol/L的醋酸钠溶液20mL与0.1mol/L的盐酸10mL混合后溶液显酸性: c(CH3COOH)-c(CH3COO-)=2[c(OH-)-c(H+)] |
| D.已知酸性HF>CH3COOH,pH相等的NaF溶液与CH3COOK溶液中: |
[c(Na+)-c(F-)]>[c(K+)-c(CH3COO-)]