化学学习中有很多形如“A+B→C+D”的反应,请根据不同的情况回答下列问题:
(1)如果上式中A、B、C、D均为多核10电子微粒,其中A为阳离子,B为阴离子,C、D均为分子,且C的相对分子质量比D大1.
则:①A+B→C+D表示的离子方程式为 。
②标准状况下,若2.24L的D被100mL 2mol/L盐酸吸收,则所得溶液中各离子浓度从大到小的顺序为_ ___.
(2)如果上式中A、C为生活中常见的金属单质,B、D为两种氧化物且它们的摩尔质量比为12:17,其中D能与NaOH溶液反应.
则:①A+B→C+D表示的化学方程式为 .
②D与NaOH溶液反应的化学方程式为___ _.
③工业上,将B、D按一定的量溶于盐酸后,继续通入气体Z,再加入NaOH溶液调节pH可得高效净水剂(化学式为CA(OH)aCl6-n ),则气体Z的作用是__ __,B、D的最佳物质的量之比是___ _.
④工业上,通常第一步先用C与过量稀硫酸作用得溶液X:第二步再往溶液X中加入亚硝酸钠来制备C(OH)SO4,同时有气体NO生成,写出第二步反应的化学方程式为__ __。
(每空1分共6分)一项科学研究成果表明,铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO)。
(1) 向一定物质的量浓度的Cu(NO3)2和Mn(NO3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMn2O4。
① Mn2+基态的电子排布式可表示为。
② NO3-的空间构型为(用文字描述)。
(2) 在铜锰氧化物的催化下,CO被氧化成CO2,HCHO被氧化成CO2和H2O。
①根据等电子原理,CO分子的结构式为。
② H2O分子中O原子轨道的杂化类型为。
③ 1molCO2中含有的σ键数目为。
(3) 向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为。
某烷烃A和烯烃B的混合气体物质的量为1 mol,质量为26 g。取8.96 L标准状况下的此混合气体通入足量溴水中,结果溴水质量增加5.6 g。由此推断A为 ,B的结构简式可能为 (不考虑顺反异构);对应的名称分别为 。
已知某有机物的结构简式为: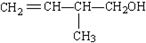
(1)该有机物中所含有的官能团的名称是____________、____________;
(2)该有机物发生加成聚合反应后,所得产物的结构简式为_______________________。
按要求写出: 的结构简式_________;
的结构简式_________;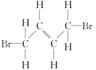 的键线式______;
的键线式______;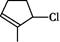 的分子式___________。
的分子式___________。
目前世界上比较先进的电解制碱技术是离子交换膜法。
(1)电解前,如果粗盐中SO42ˉ含量较高,必须添加试剂除去SO42ˉ,则按添加试剂顺序,依次发生反应的离子方程式为。
(2)补齐下列电解饱和食盐水制烧碱的离子方程式:
______________________  __________________________________
__________________________________
(反应物)(阴极产物)(阳极产物)
(3)在电解制得的NaOH中往往还含有一定量的NaCl,因此必需进行脱盐工序,脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过、冷却、(填写操作名称)除去NaCl。
(4)已知NaCl在60℃的溶解度为37.1 g,现电解60℃精制饱和食盐水1371 g。经分析,电解后溶液密度为1.37 g·cm-3,其中含有20gNaCl,则电解后NaOH的物质的量浓度为__________mo1·L-1(保留小数点后1位)。