某工业废水含有Cu2+、Fe3+、 Al3+、Fe2+、Cl-、NO3-、SO42-、SiO32-中的5种,且各种离子的物质的量浓度相等,均为0.1mol/L。为探究废水的组成,甲同学进行如下实验:
Ⅰ.取少量溶液,加入KSCN溶液无明显变化。
Ⅱ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅲ.向Ⅱ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
(1)由Ⅰ判断,溶液中一定不含有的阳离子是 (写离子符号);
(2)Ⅱ中生成的无色气体是 ,生成无色气体的反应中被氧化的离子是 ;
(3)甲同学最终确定原溶液中所含阳离子是 ,阴离子是 (写离子符号);
(4)工业废水中常含有不同类型的污染物,可采用不同的方法处理。以下是乙同学针对含不同污染物的废水提出的处理措施和方法,其中正确的是 
高纯度单晶硅是典型的无机非金属材料,是制备半导体的重要材料,它的发现和使用曾引起计算机的一场“革命”。高纯硅通常用以下方法制备:用碳在高温下还原二氧化硅制得粗硅(含Fe、Al、B、P等杂质),粗硅与氯气反应生成四氯化硅(反应温度为450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置图。
相关信息:a.四氯化硅遇水极易水解;b.硼、铝、铁、磷在高温下均能与氯气直接化合生成相应的氯化物;c.有关物质的物理常数见下表:
| 物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
| 沸点/℃ |
57.7 |
12.8 |
— |
315 |
— |
| 熔点/℃ |
-70.0 |
-107.2 |
— |
— |
— |
| 升华温度/℃ |
— |
— |
180 |
300 |
162 |
请回答下列问题:
(1)仪器e的名称为,装置A中f管的作用是,其中发生反应的离子方程式为。
(2)装置B中的试剂是。
(3)某学习小组设计了以下两种实验方案:方案甲:g接装置Ⅰ;方案乙:g接装置Ⅱ。但是甲乙两个方案中虚线内装置均有不足之处,请你评价后填写下表。
| 方案 |
不足之处 |
| 甲 |
|
| 乙 |
(4)在上述(3)的评价基础上,请设计一个合理方案:。
(5)通过上述合理的装置制取并收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是(填写元素符号)。
绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
已知:室温下饱和H2S溶液的pH约为3.9,SnS沉淀完全时溶液的pH为1.6;FeS开始沉淀时溶液的pH为3.0,沉淀完全时的pH为5.5。
(1)检验制得的绿矾晶体中是否含有Fe3+的实验操作是______________________________。
(2)操作II中,通入硫化氢至饱和的目的是 ;在溶液中用硫酸酸化至pH=2的目的是 。
(3)操作IV的顺序依次为: 、 ___、 。
操作IV得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;② 。
(4)测定绿矾产品中Fe2+含量的方法是:a.称取2.8500g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL(滴定时发生反应的离子方程式为:5Fe2++MnO4¯+8H+→5Fe3++Mn2++4H2O)。
①判断此滴定实验达到终点的方法是 。
②计算上述样品中FeSO4·7H2O的质量分数为 _(用小数表示,保留三位小数)。
碱式碳酸铜【Cu2(OH)2CO3】是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
步骤一:废铜屑制硝酸铜
如图,用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。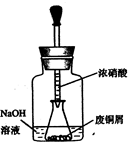
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
完成下列填空:
(1)写出浓硝酸与铜反应的离子方程式:。
(2)上图装置中NaOH溶液的作用是_。反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有____(填写化学式)。
(3)步骤二中,水浴加热所需仪器有___、_(加热、夹持仪器、石棉网除外);
(4)步骤二的滤液中可能含有CO32-,写出检验CO32-的方法:
(5)影响产品产量的主要因素有____。
(6)若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是____。
某化学小组用下列装置抽取收集纯净的氯气,并研究其性质。请回稳下列问题。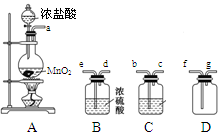
(1)装置A中发生反应的离子方程式为_______________________________。
(2)按照气流方向各仪器接口的连接顺序为a→___________________→g。
(3)装置B中浓硫酸的作用是____________________________________________________________,装置C的试剂最好是___________________________________。
(4)某同学认为上述方案缺少尾气吸收装置,请在下面的方框中画出该装置并注明试剂。
(5)装制取的氯气通入下图所示装置中,甲装置溶液中具有氧化性的含氯粒子是_______;如何证明乙装置中FeCl2溶液与Cl2发生了反应?(只回答需要的试剂和现象)___________________________。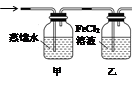
某学校兴趣小组设计如下装置进行实验探究(a、b为弹簧夹,加热及固定装置已略去)。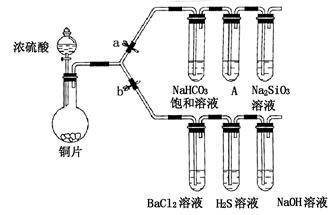
(1)验证碳、硅非金属性的相对强弱
①连接仪器、、加药品后,打开a关闭b,然后滴入浓硫酸,加热;
②装置A中的试剂是;
③能说明碳的非金属性比硅强的实验现象是。
(2)验证SO2的氧化性、还原性和酸性氧化物的通性
①打开b,关闭a。能验证SO2具有氧化性的化学方程式是;
②若过量的SO2通入NaOH溶液中,其离子方程式是;
③BaCl2溶液中无沉淀现象,将其分成两份,分别滴加下列溶液,将产生的沉淀的化学式填入下表相应位置。
| 滴加的溶液 |
氯水 |
氨水 |
| 沉淀的化学式 |
写出其中SO2显示还原性并生成沉淀的离子方程式。