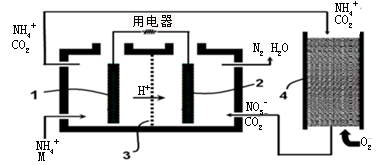
已知一些单质、化合物的沸点(1.01×105Pa,单位:℃)如下表所示: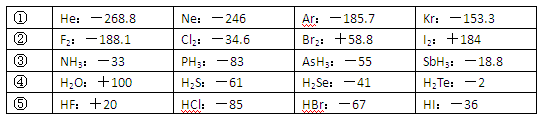
结合上表有关信息回答下列问题:
(1)判断下列说法不正确的是
| A.同周期元素的氢化物,原子序数越大,沸点越高 |
| B.上表中H2O、HF中由于含有氢键,故其分子特别稳定 |
| C.上表中,多数物质的沸点均与相对分子质量存在一定的关系 |
| D.周期表中各主族元素的单质其沸点都随原子序数的增大而升高 |
E.氢化物的稳定性越高,其沸点越高
(2)写出②系列中物质主要化学性质的递变规律(任写一种): ;能说明该递变规律的化学事实是 (任写一例,用离子方程式表示)。
(3)除极少数情况,同一系列中物质的沸点与相对分子质量之间存在一定的关系,该关系是 。
(4)部分XX’型卤素互化物(X、X’表示不同的卤原子)和卤素单质的沸点也与其相对分子质量存在着如右图所示的关系。试推测ICl的沸点所处的最小范围 (填“物质的化学式”)。
【化学——选修3:物质结构与性质】已知A、B、C、D、E、F为前四周期的六种元素,原子序数依次增大,其中A位于周期表的s的区,其原子中电子层数和未成对电子数相同;B原子价电子排布式为nsnnpn,B和E同主族,D原子的最外层电子数是其内层的3倍;F元素位于元素周期表的第四行、第十一列。试回答下列问题:
(1)基态F原子的核外电子排布式为 。
(2)关于B2A2的下列说法中正确的是____ (填选项序号)。
①B2A2中的所有原子都满足8电子稳定结构
②每个B2A2分子中 键和
键和 键数目比为1:1
键数目比为1:1
③B2A2是由极性键和非极性键构形成的非极性分子
④B2A2中心原子的杂化类型为sp杂化
(3)B、C、D三种元素第一电离能按由大到小的顺序排列为 (用元素符号表示)。
(4)C的气态氢化物与C的最高价氧化物对应的水化物反应生成一种盐H,H晶体中存在的化学键类型有____(填选项序号)。
①离子键②共价键 ③氢键 ④配位键 ⑤金属键
(5)基态E原子的最高能层具有的原子轨道数为____ ;B和E分别与氧元素形成的最高价氧化物中,熔沸点较高的是 (写化学式);
(6)F单质的晶体堆积方式为面心立方,其配位数为 ;若F的相对分子质量为M,它的晶胞棱长为a(cm),则F晶体的密度为 g·cm-3。(阿伏伽德罗常数为NA)
【原创】将 转化为甲醇可以有效利用资源,同时又可控制温室气体,
转化为甲醇可以有效利用资源,同时又可控制温室气体,
原理为:
(1)由下列反应的能量变化,求算制取1mol甲醇放出 KJ。
(2)利用甲醇气体为原料的一种燃料电池,其中一极通空气,电解质为可能过 的钇锆氧化物。电池工作时正极反应 。以该电池为电源,用石墨做电极电解含0.1molCuSO4、0.4molHCl的溶液。一段时间后,当在阴极收集到标况下6.72L气体时,相同条件下(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到气体的物质的量为 mol。
的钇锆氧化物。电池工作时正极反应 。以该电池为电源,用石墨做电极电解含0.1molCuSO4、0.4molHCl的溶液。一段时间后,当在阴极收集到标况下6.72L气体时,相同条件下(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到气体的物质的量为 mol。
(3)甲醇对水质会造成一定的污染,可细菌的作用下,用氨(NH3)处理含甲醇(CH3OH)的工业废水,使其变成无毒的CO2和N2,从而消除对环境的污染,化学方程式为: ,该过程中被氧化的元素是 ,当产生标准状况下2.24L 时,共转移电子 mol。
时,共转移电子 mol。
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为 。
(2)Y元素原子的价层电子的电子排布图为 。
(3)X与Z可形成化合物XZ3,该化合物的空间构型为 。
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是___________________________________________________________。
(5)比较X的氢化物与同族第二、三周期元素所形成的氢化物稳定性、沸点高低并说明理由
_________________________________________________________________________。
【改编】甲、乙、丙、X是中学化学中常见的物质,在一定条件下,它们之间的转化关系如下图所示(部分产物已略去):,请回答下列问题:
(1)若X是 O2,则甲不可能是______(填代号)
a.Mg b.N2 c.S d.Al
(2)若甲能使湿润的红色石蕊试纸变蓝,丙为红棕色气体。写出甲转化为乙的化学方程式:________________________________________。
(3)若乙是一种常见的温室气体,则构成X的元素的电子排布式为__________。
(4)若丙为淡黄色粉末,常用作呼吸面具中的供氧剂,则丙与水反应的离子方程式为 ;1mol丙与水发生反应时转移电子的物质的量为______mol。
(5)若X是一种常见的金属单质,常温下甲的浓溶液可盛放在铝制容器中,丙为浅绿色溶液。
①检验乙是否完全转化为丙的试剂为____ ___(填试剂名称)。
②保存丙溶液常加入少量X,其目的是______ ______。
【原创】(12分)已知 X、Y、Z、W是原子序数依次增大的四种短周期元素,Y元素形成的化合物种类最多;W原子有2个未成对电子。X、Y、W三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体。Q是第四周期元素,最外层只有一个电子,其余各层电子均充满。
请回答下列问题(用元素符号或化学式表示):
(1)元素Y、Z、W的基态原子的第一电离能由大到小的顺序为 。
(2)M分子中Y原子轨道的杂化类型为 。
(3)Q+的核外电子排布式为 ,下图是由W、Q形成的某种化合物的晶胞结构示意图,该晶体的化学式 。(黑球代表Q原子)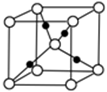
(4)化合物ZX3的沸点比化合物YX4的高,其主要原因是 。
(5)Z2X4在碱性溶液中能够将QW还原为Q2W,已知当1mol Z2X4完全参加反应时转移了4 mol电子,则该反应的化学方程式可表示为: 。
(6)一种处理汽车尾气中ZW、YW2的方法是在催化剂作用下使两者反应成无污染的气态。已知反应生成1gZ的单质时放出4.3kJ热量。此反应的热化学方程式为 。
(7)微生物燃料电池是一种利用微生物将有机物中的化学能直接转化成电能的装置.最早用于有机废水处理,下图是利用微生物燃料电池处理含M废水的装置,其中3是质子交换膜.负极所在的左室中发生反应的电极反应式是 。