某兴趣小组话动中,在空气中点燃镁条时,发现在生成的白色固体物质中夹杂着少量的淡黄色固体。为了探究其原因,小组成员进行了以下探究活动:
[提出问题]淡黄色固体物质的成分是什么?
[查阅资料]通过查阅资料,记录了下列几种物质的颜色:
| 物 质 |
MgO |
MgCl2 |
Mg3N2 |
Mg(NO3)2 |
MgCO3 |
Mg(OH)2 |
| 颜 色 |
白色 |
白色 |
淡黄色 |
白色 |
白色 |
白色 |
小组成员一致认为产物中一定不含有氯化镁,理由是 。
[提出猜想]淡黄色的固体可能是 。(填化学式)
[实验探究](1)按下图所示装置收集氮气(关闭a、b、c,用凸透镜聚光引燃白磷,待白磷不再燃烧并冷却至室温后,打开a、b、c,使用打气筒进行充气)
(2)B装置点燃白磷的作用是 。
(3)用排水法收集好氮气后,接下来的实验操作是 。
[实验结论]猜想是正确的。镁条在氮气中燃烧的有关化学反应方程式是
。
[实验反思]本探究活动对物质燃烧新的认识是 。
某实验小组的同学用氢氧化钙溶液和盐酸进行酸碱中和反应的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸一会后,发现忘记了滴加指示剂。因此,他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。
Ⅰ、写出该中和反应的化学方程式:。
Ⅱ、探究烧杯内溶液中溶质的成分。
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想一:可能是CaCl2和Ca(OH)2;猜想二:可能只有CaCl2;猜想三:。
【查阅资料】氯化钙溶液呈中性。
【进行实验】
实验步骤:取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡
实验现象:
结论:猜想一不正确
实验步骤:实验步骤取少量烧杯内溶液于另一支试管中,逐滴加入碳酸钠溶液至过量
实验现象:
结论:猜想二不正确,猜想三正确
【反思与拓展】
(1)在分析化学反应后所得物质成分时,除考虑生成物外还需考虑。
(2)根据所学化学知识,验证烧杯内溶液中的溶质含有HCl,除以上方案外,下列哪些物质单独使用也能完成该实验?(填序号)
a.pH试纸 b.铜 c.紫色石蕊溶液 d.硝酸银溶液
(3)烧杯中的溶液未经处理直接倒入下水道,可能造成的危害是(写一条)。要处理烧杯内溶液,使其溶质只含有CaCl2,应向烧杯中加入过量的。
已知某种治疗胃病药品的主要成份是铝碳酸镁片,化学式为AlaMgb(OH)16CO3·4H2O,假设药品中的其它成份受热不分解、不溶于水且不与稀硫酸反应。某研究性学习小组设计了如下实验探究铝碳酸镁片的组成。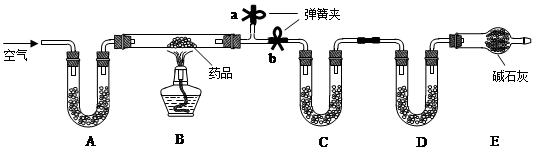
【实验一】取m g该药片,研成粉末放入硬质玻璃管中,加热,充分反应后测得装置C增重2.16g,装置D增重0.44g。
(1)铝碳酸镁片加热分解的产物为Al2O3、MgO、CO2和水,则为分别测定CO2和水的质量,装置C和D中盛放的药品应选择:CD(填序号)。
①浓硫酸②碱石灰③氯化钙④纯碱
(2)实验开始前先通入一定量空气,其操作方法是关闭弹簧夹,打开弹簧夹,目的是。
(3)一段时间后,打开弹簧夹,关闭弹簧夹,点燃酒精灯加热,充分反应后,停止加热,继续通入空气至玻璃管冷却的目的是(填序号)。
①排净空气防爆炸
②防止空气中水和二氧化碳进入C、D影响测定
③使生成水和二氧化碳进入C、D被充分吸收
【实验二】另取m g该药片,加入100 g 9.8%的稀硫酸,充分反应后滤去不溶物,得到含有MgSO4和Al2(SO4)3等溶质的滤液,向滤液中逐渐加入足量的稀NaOH溶液,产生沉淀的物质的质量与加入NaOH质量的关系如图。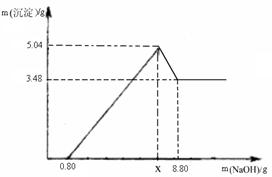
已知:MgSO4+2NaOH=Mg(OH)2↓+Na2SO4
Al2(SO4)3+6NaOH=2Al(OH)3↓+3Na2SO4
Al(OH)3+NaOH=NaAlO2+2H2O,
Mg(OH)2不溶于NaOH, NaAlO2可溶于水。
(1)图中NaOH加入0.80g,仍没有沉淀,说明滤液中含。当加入NaOH的质量到x时,生成的沉淀有和,其中Al(OH)3的质量是g,则x=g。
(2)有医生建议患有严重胃溃疡的患者最好慎用该药,试用你所学的知识解释这样建议的理由是。
(3)试确定铝碳酸镁的化学式为。
材料:2013年12月2日,“嫦娥三号”探测器由长征三号运载火箭发射,首次实现月球软着陆和月面巡视勘察。12月15日晚,“嫦娥三号”着陆器和巡视器(玉兔月球车)成功分离,顺利互拍,任务取得圆满成功。长征三号运载火箭主要用于发射地球同步轨道有效载荷,它的一子级和二子级使用偏二甲肼(C2H8N2)和四氧化二氮(N2O4)作推进剂,三子级则使用效能更高的液氢(H2)和液氧(O2)。
(1)“长征三号”三子级火箭用液氢做燃料,其反应的化学方程式为,使用液氢做燃料的优点有:(填一条)。
(2)下列有关偏二甲肼(C2H8N2)的叙述正确的是
| A.由2个碳原子,4个氢原子,一个氮分子组成 |
| B.由碳、氢、氮三种元素组成 |
| C.由2个碳原子,8个氢原子,2个氮原子构成 |
| D.偏二甲肼中碳、氢、氮的原子个数比为1:4:1 |
(3)“玉兔”月球车(如图)主体为长方形盒状,车底安有六个轮状的移动装置,顶部两片太阳翼可以打开,太阳翼打开可将太阳能转化成能,为“玉兔”提供能源的还有锂电池和核电池。“玉兔号”对“车轮”要求极高。月球车底盘和车轮由铝合金材料制成,这是由于铝合金具有质轻坚硬的特性。
(4)看见玉兔车金灿灿的车身后,小聪想到家里新换的水龙头。从说明书上了解到该水龙头是铜质镀铬。好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,请你一同参加。
【知识回放】
金属活动性顺序:K Ca Na Al Zn Fe Sn Pb(H)Cu Ag Pt Au。请你在横线上填写对应金属的元素符号。
【作出猜想】
猜想1.Cr>Fe>Cu;猜想2.Fe>Cu >Cr;猜想3.你的猜想是。
【查阅资料】
①铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
②铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
【设计与实验】
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸。
| 实验 |
试管1 |
试管2 |
试管3 |
| 实验 操作 |
 |
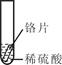 |
 |
| 实验 现象 |
铁片表面产生气泡较慢,溶液变为浅绿色 |
铬片表面产生气泡较快,溶液变成为蓝色 |
【结论与解释】
①小聪得到的结论是猜想正确。
②实验前用砂纸打磨金属片的目的是。
【知识运用】
将铬片投入FeSO4溶液中,反应(填“能”或“不能”)进行。若能进行,请你写出反应的化学方程式。
同学们对实验“煅烧石灰石”展开深入探究。
资料:石灰石中的杂质高温不分解且不与稀盐酸反应
(1)为证明石灰石已分解,三位同学从其他角度设计方案如下:
Ⅰ.甲同学按图一所示进行实验(煤气灯亦能达到石灰石分解的温度),观察到烧杯内壁石灰水变浑浊,写出石灰水发生反应的化学方程式。
II.乙同学按图二所示进行试验,观察到B中液体变色,A实验的作用。
III.丙同学取一块石灰石煅烧,一段时间后发现固体质量减轻2.2g,证明石灰石已分解。
IV.大家认为甲同学的方案不合理,请分析原因。
(2)为测定石灰石的纯度,丙同学将他刚才煅烧后的固体放入足量稀盐酸中,又产生2.2g气体,结合上述数据计算可知,丙所取的这块石灰石中含碳酸钙g。
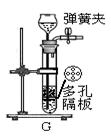
小组在实验室进行关于气体的实验,所用的部分仪器如下图所示。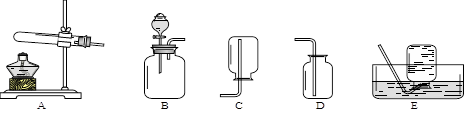
(1)甲同学用双氧水制取氧气,发生反应的化学方程式是,选择的收集装置是D或,用检验D收集满氧气。
(2)乙同学用氯酸钾和二氧化锰为原料制取氧气,二氧化锰的作用是,应选择的发生装置是。该同学发现产生的气体能使带火星的木条复燃并有刺激性气味,下列分析不合理的是。
a.反应中氧气的物理性质发生了变化
b.此时得到的气体一定是混合物
c.只加热氯酸钾,若生成的气体无气味,说明刺激性气味一定与二氧化锰有关
d.可能是生成的氧气与残留在发生装置中的空气在加热的条件下反应生成了新物质。
(3)丙同学研究了木条复燃与氧气体积分数的关系,发现不纯的氧气也能使带火星的木条复燃。右图F是他其中一次实验的装置,集气瓶中有约占总体积40%水,氧气从导管口进入,排尽集气瓶中的水,收集氧气后集气瓶中氧气的体积分数是。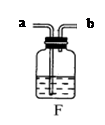
(4)如图装置也可制取二氧化碳气体,制取二氧化碳的化学方程式为。G装置的优点是可随时控制反应的发生和停止。若打开弹簧夹,固体与液体接触,反便能发生,请简述使G装置中反应停止的操作。