有位同学设计了下列实验(装置及所用药品如图所示),仔细观察后回答下列问题。
(1)A处在给氧化铁加热时温度不够高如何改进?
写出A处改进后发生反应的化学方程式
(2)在C处看到的现象是 说明反应后有 生成,反应的化学方程式为 。
(3)本实验设计中,在B处所采取措施的目的是 ,
其优点是 。
红枣包装中常使用一种袋装防腐剂,品名为“504双吸剂”,其标签如图所示。同学们对一包久置的“504双吸剂”固体样品很好奇,设计实验进行探究。
提出问题:久置固体的成分是什么?
查阅资料:铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
作出猜想:久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2、CaCO3。
久置固体中可能含有Ca(OH)2的原因是:
用化学方程式表示。
实验探究1:甲同学的方案(见下表)。
| 实验操作 |
实验现象 |
实验结论 |
| (1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 |
固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红 |
固体中一定含有 和氢氧化钙 |
| (2)另取少量固体放于试管中,滴加足量 的 |
固体逐渐消失,有大量无色气体产生,得到浅绿色溶液 |
固体中一定含有, 一定不含有Fe2O3 |
| (3)将步骤(2)中产生的气体通入到澄清石灰水中 |
固体中一定含有CaCO3 |
实验质疑:(1)乙同学认为甲同学的实验中的实验中不能得出一定含有Ca(OH)2的结论,理由是。
(2)丙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是。
实验探究2:乙、丙同学设计如下图所示实验方案继续验证。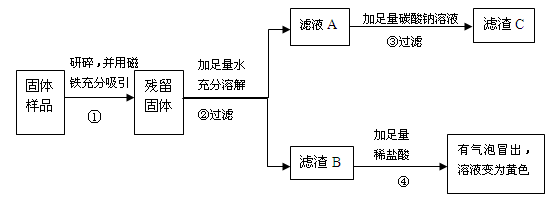
(1)③中反应的化学方程式是。
(2)乙、丙同学实验中又能得出固体样品中一定还含有,
仍有一种物质不能确定,该物质是。
资料表明:在不同温度下,CO可将Fe2O3还原为Fe、Fe3O4中的一种或两种。为探究温度对该反应产物的影响,进行如下实验。
【查阅资料】
Ⅰ.Fe3O4与盐酸反应,得到FeCl2和FeCl3的混合溶液
Ⅱ.用溶质质量分数一定的FeCl2和FeCl3溶液进行如下实验,为方案设计提供参考
| FeCl2溶液 |
FeCl3溶液 |
|
| 加入Fe |
无明显变化 |
溶液变成浅绿色 |
| 加试剂A |
无明显变化 |
溶液变成红色 |
【实验过程】
甲、乙两组同学分别用酒精灯和酒精喷灯作为热源进行CO还原Fe2O3的实验,检验得到的黑色固体的成分,实验记录如下。
| 实验操作 |
实验现象 |
结论与解释 |
| ①取少量的黑色固体于试管中,滴加适量的______ ②向步骤①所得的溶液中,滴加试剂A |
甲组: 固体溶解,无气泡冒出 加试剂A后,溶液变成红色 |
黑色固体的成分是______ 甲组用CO还原Fe2O3反应的化学方程式是______ |
| 乙组: 固体溶解, 加试剂A后,溶液颜色无明显变化 |
黑色固体的成分是Fe |
【实验反思】
(1)结合此次探究活动,你认为下列说法正确的是______(填序号)。
a.温度会影响反应的产物
b.试剂A用于检验FeCl3溶液
c.进行CO还原Fe2O3的实验时,一定要进行尾气处理
d.得到的黑色固体的质量一定小于参加反应的Fe2O3的质量 (2)有人认为乙组的实验结论有欠缺,你是否认同此观点,其理由是。
(2)有人认为乙组的实验结论有欠缺,你是否认同此观点,其理由是。
6分)实验小组对久置生石灰的成分进行分析,实验操作及部分现象如下图所示。
【资料:Na2CO3+CaCl2 =" 2NaCl" + CaCO3↓】
回答下列问题:
(1)样品加水放热的原因是(用化学方程式表示)。
(2)②中反应的化学方程式是。
(3)③中的实验现象是。
(4)将混合物B、C、D倒入一个洁净的烧杯中,发现烧杯中有白色沉淀且上层清液呈红色,过滤,得滤液E和1 g滤渣。向滤液E中滴加CaCl2溶液,有白色沉淀生成,则滤液E中的溶质可能是。
依据实验现象及数据判断,原样品的成分是。
课外小组同学在实验室发现了一瓶标签残缺的无色液体(下图),想通过探究确定其成分,以便重新利用。
【初步分析】操作不规范可能造成标签破损,能造成标签破损的不当操作有(写一点)。根据受损标签的情况判断,这瓶试剂不可能是(填字母代号)。
A.酸B.碱 C.盐
【查阅资料】初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。有关四种物质的信息如下:
| 物质 |
NaCl |
NaOH |
Na2CO3 |
NaHCO3 |
| 20oC溶解度/g |
36 |
109 |
21.5 |
9.6 |
| 水溶液的pH |
7 |
14 |
11 |
9 |
【实验探究】为确定该溶液的成分,小芳设计了如图乙所示的实验过程:

(1)实验①观察到紫色石蕊试液变蓝,由此得出结论是。
(2)实验②观察到有气泡产生,还有可能观察到的现象是。
【得出结论】通过以上活动,小刚认为不能确定瓶中试剂的成分,小芳认为可以,小芳的理由是。
【拓展应用】通过以上探究活动,小组同学联想到二氧化碳与氢氧化钠的反应,设计了如图丙所示实验,观察到的现象是。
氨对工业及国防具有重要意义,化学小组的同学设计了如下图所示的装置用于制取少量氨气。
完成以下实验操作中的相关问题:
(1)检查装置气密性
(2)关闭a、c,打开b,从长颈漏斗加入稀盐酸,A中发生反应的化学方程式为。在F的出口处收集氢气并验纯。
(3)关闭c,在盛满空气的多孔玻璃钟罩内用激光点燃足量的白磷。反应的化学方程式为。其目的是 。
(4)待多孔玻璃钟罩冷却到室温,打开a,观察到的现象是。
(5)点燃酒精灯加热玻璃管E,并打开C。氢气和氮气在铁触媒的催化作用下生成氨气,反应的化学方程式为。 实验过程中D装置的作用是。