有下列物质:① MgF2②Na2O2③NaOH ④HCl ⑤H2O2⑥NH4Cl ⑦Cl2
(1). 只由极性键构成的物质是________;只由非极性键构成的物质是__ __;
只由非金属元素组成的离子化合物是____; 由离子键和非极性键构成的物质是_____________,由极性键和非极性键构成的物质是______________.(填序号)
(2).已知:Zn(s)+1/2O2(g)==ZnO(s);ΔH=-348.3 kJ/mol
2Ag(s)+1/2 O2(g)="=" Ag2O(s);ΔH=-31.0 kJ/mol
则Zn(s)+ Ag2O(s)="=" ZnO(s)+ 2Ag(s)的ΔH=
(3).氧化还原反应中除了原子守恒(质量守恒)外,氧化剂得电子总数和还原剂失电子总数相等,在一定条件下, 和I-发生反应的离子方程式为:
和I-发生反应的离子方程式为: +6I-+6H+=R-+3I2+3H2O(R为主族元素)则:
+6I-+6H+=R-+3I2+3H2O(R为主族元素)则:
① 中R的化合价为 价,n值为 。
中R的化合价为 价,n值为 。
②R元素最外层电子数为 个,在周期表的 族。
浓硫酸和碳在加热的情况下反应的化学方程式为C+2H2SO4=CO2↑+2SO2↑+2H2O为了验证反应的各种生成物,用如图Ⅰ装置进行实验。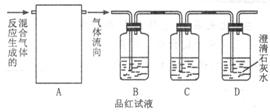
图Ⅰ
(1)图Ⅰ中A处是完成实验中的必要装置,它是下列图Ⅱ所示中的(填编号)_________;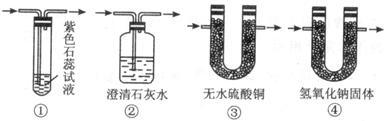
图 Ⅱ
(2)C装置中应盛的试剂为足够_______________,其作用__________;
(3)能够确定存在二氧化碳气体的实验现象_______________________。
在氯化亚铁溶液中,加入氯水,振荡后溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,使溶液变黄色的粒子是;乙同学认为这是发生化学反应所致,使溶液变黄色的粒子是 ;(以上2空填相应微粒的符号)
(2)现提供以下试剂:
| A.酸性高锰酸钾溶液 | B.氢氧化钠溶液 |
| C.四氯化碳 | D.硫氰化钾溶液 |
请判断哪位同学的推断是正确的,并用两种方法加以验证,写出选用的试剂编号及实验中观察到的现象。
| 同学正确 |
选用试剂 |
实验现象 |
| 第一种方法 |
||
| 第二种方法 |
已知盐酸加到品红溶液中,由于酸性增强使品红溶液的红色加深。试推测:
(1)向品红溶液中通入过量SO2的过程中,观察到的现象为_________;
加热后的现象为________。
(2)向品红溶液中通入过量Cl2的过程中,观察到的现象为_________;
加热后的现象为_________。
(3)向品红溶液中通入物质的量之比为1∶1的SO2和Cl2后现象________。
(12分)A~G各物质间的关系如下图,其中B、D为气态单质。
MnO2①Fe点燃
MnO2②△
请回答下列问题:
(1)物质C和E的名称分别为________、________;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式___________;
若只能在加热情况下进行,则反应物A应为________;
(3)反应②的化学方程式为_____________________;
(4)新配制的F溶液应加入________以防止其转化为G。检验G溶液中阳离子的常用试剂
是________,实验现象为_____________________________。
硅和氮均是自然界含量丰富的元素,其单质及其化合物在环境、能源及材料科学中有着重要影响和广泛应用.试回答下列问题:
(1) 向大气中排放NOx可能导致的环境问题有.(答两点)已知足量NaOH溶液能完全吸收NO2生成氮的两种含氧酸盐(氮为+3、+5价).试写出该反应的离子方程式.
(2) 光导纤维的作用,让人们的生活更加丰富精彩,是制备光导纤维的基本原料.
(3) 氮化硅陶瓷是一种新型无机非金属材料,其化学式为,可由硅粉(用Al2O3和Y2O3作助剂)在氮气中高温烧结而成,氮气在反应中既是反应物,同时又起了
作用.由于使用的硅粉表面含二氧化硅,在反应中需加入碳粉.在烧结过程中,二氧化硅、碳、氮气以物质的量之比3∶6∶2反应生成两 种化合物,该反应的化学方程式为.
(4) 硅燃烧放出大量热量,“硅能源”有望成为二十一世纪的新能源.与“氢能源”比较“硅能源”具有等更加优越的特点,从而得到全球的关注和期待.