下图为实验室中常见的装置。试根据题目要求,回答下列问题: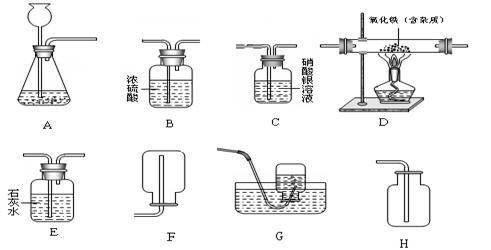
(1)以石灰石和稀盐酸为原料制取并收集干燥、纯净的二氧化碳(提示:盐酸中挥发出的少量HCl气体可用硝酸银溶液吸收)。
①所选装置的连接顺序为A→ (填写装置序号字母)。
②装置A中发生反应的化学方程式为 。
③装置B的作用是 。
④装置C中出现的现象为 。
(2)若用一氧化碳气体(含少量水蒸气)来测定某不纯氧化铁样品的纯度,气体流向是从左向右,选择的装置按B1→D→E→B2顺序连接,然后进行实验(假设有关反应均反应完全)。
①装置D中发生反应的化学方程式是 。
②对于上述设计的这个实验装置,你认为还需要改进的是 。
③通过测量反应前、后E洗气瓶的质量变化来计算氧化铁样品的纯度。若氢氧化钙溶液的量不足,则计算出样品纯度的结果将 (填“偏小”、“偏大”、“不受影响”之一)。
兴趣小组选用第15题中的B装置(装置气密性良好)制
,并进行有关实验。
(1)实验室制取
的化学方程式为。
(2)兴趣小组往石灰石中逐滴滴入新配制的盐酸,并将所得气体通入澄清石灰水中,但石灰水始终没有浑浊现象。石灰水为什么没有浑浊呢?请你利用必需实验用品和限选试剂(限选试剂:
溶液、酸化的
溶液、紫色石蕊溶液)完成探究过程:
【提出猜想】①;②;③上述两种猜想同时存在。
【设计与实验】请你设计实验方案,验证猜想①和猜想②,并将相关内容填在下表:
某学习小组对市售"管道通"(排水管专用清洁剂)说明书的部分内容(如下图所示)产生兴趣,探究过程如下:
成 分:苛性钠、碳酸钠、铝粒、催化剂.
特 点:使用时,"管道通"样品倒入排水口,加水,瞬间释放高效泡沫,能溶解油脂、毛发、茶叶等,确保管道畅通.
注意事项:使用时不能碰明火,禁止与皮肤接触.
【提出问题】高效泡沫中含有什么气体
为什么使用时不能碰明火
【猜 想】含有氢气.
(1)查阅资料得知:常温下,铝能与氢氧化钠溶液反应放出氢气.反应的化学方程式是
,试推测
的化学式是.
(2)取"管道通"样品进行下图所示实验.请在下表空格处填写相应内容:
| 实验内容 | 实验现象 | 实验结论及解释 |
制取气体 |
样品逐渐减少,产生大量气泡,盛装样品的试管外壁发烫 | ①反应生成气体,并(填"吸收"或"放出")热量 |
|
检验气体
|
发出爆鸣声 | ②该气体是,反应的化学方程式为 |
(3)"注意事项"中,"禁止与皮肤接触"是因为"管道通"成分中的有强腐蚀性,使用时"不能碰明火"的理由是.
草木灰是农家肥料,它的主要成分是一种含钾的盐。请根据下图实验回答有关问题。
(1)操作Ⅰ的名称是,此操作中需要用到的玻璃仪器有:烧杯、玻璃棒和。蒸发过程中需要用到玻璃棒,它的作用是.
(2)取滤液加入盐酸,生成的气体使澄清石灰水变浑浊,由此可推断草木灰的主要成分是(写名称)。上述有关反应的化学方程式为、。
(7分)某班同学做验证铁、铜、银的金属活动性顺序的实验,用到的药品有铁丝、铜丝、银丝、稀硫酸和硫酸铜溶液。实验结束后,化学兴趣小组的同学欲对该实验的废液进行探究,请你一起参与。
【提出问题】废液中含有什么物质?
【交流表达】(1)小明通过观察,认为废液中一定含有硫酸铜。他观察到的现象是_____。
(2)小红通过分析,认为废液中一定含有硫酸亚铁,她的依据是______________________。
【作出猜想】小华认为废液中还可能含有硫酸。
【实验验证】(1)小华测得废液的pH小于7,证明废液中含有硫酸。用pH试纸测定溶液pH的方法是________________________________________________________________。
(2)小明取少量废液,向其中滴加氢氧化钠溶液,也得到了相同的结论。小明的实验现象是_______________________________。通过分析与实验,同学们得出废液中含有硫酸亚铁、硫酸铜和硫酸。
【拓展应用】
(1)若将废液中的溶质全部转化为硫酸亚铁,应向废液中加入过量的______________。写出该反应过程中的一个化学方程式______________________________________________。
(2)反应完全后,过滤,滤渣中物质为________________,滤液中溶质为硫酸亚铁。
如图所示为实验室常用的实验装置:
据图回答下列问题:
(1)写出带有标号的仪器名称:①,②。
(2)实验室通常用石灰石与稀盐酸反应制取二氧化碳,应选用的发生装置是(填序号,
下同),收集装置是。该反应的文字表达式为。
(3)F装置可用来测量生成的二氧化碳气体的体积,其中在水面上防一层植物油的目的
是,植物油上方原有的空气对实验的结果(填“有”或“没有”)明
显影响。
(4)实验室用高锰酸钾(KMnO4)制取氧气,应选用的发生装置是,收集装置是。该反应的文字表达式为。该反应属于 _______ 基本反应类型。
(5)某同学称取一定质量KMnO4放在大试管中,将温度控制在250℃加热制取O2,实验结束时,该同学发现收集到的O2大于理论产量,针对这一现象,同学们进行了如下探究:
【提出猜想】猜想l:反应生成的MnO2分解放出O2;猜想Ⅱ:反应生成的锰酸钾(K2MnO4)
分解放出O2做出上述猜想的理由是____________________________ 。
【实验验证】同学们分为两组,分别进行以下实验:
①第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变。则猜想_______错误。
②第二组同学取K2MnO4在250℃条件下加热,没有用测定质量的方法,也得出了猜想Ⅱ正确的结论。该组同学选择的实验方法是______________________________________ 。
【拓展延伸】实验发现,K2MnO4受热只能部分分解,经分析可能是生成物氧化钾(K2O)
对其分解产生影响。请设计实验方案验证:______________________________。
【实验反思】通过以上实验探究,该生对“问题的发现与解决”有何认识:必须通过认真分析,
用实验来加以证明。