在元素周期表中前四周期的五种元素的位置关系如图所示。若B元素的核电荷数为Z,则五种元素的核电荷数之和为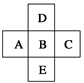
| A.5Z | B.5Z+18 |
| C.5Z+10 | D.5Z+8 |
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中元素A、E的单质在常温下呈气态,元素B的原子最外层电子数是其电子层数的2倍,元素C在同周期的主族元素中原子半径最大,元素D的合金是日常生活中常用的金属材料。下列说法正确的是
A.元素A、B组成的化合物常温下一定呈气态
B.最高价氧化物对应水化物的碱性:C>D
C.化合物AE与CE具有不同类型的化学键
D.一定条件下,元素C、D的最高价氧化物对应的水化物之间不能发生反应
部分弱电解质的电离平衡常数如下表:
| 弱电解质 |
HCOOH |
HCN |
H2CO3 |
NH3·H2O |
| 电离平衡常数 (25℃) |
Ka=1.8×10-4 |
Ka=4.9×10-10 |
Ka1=4.3×10-7Ka2=5.6×10-11 |
Kb=1.8×10-5 |
下列说法不正确的是
A.结合H+的能力:CO32->CN->HCO3->HCOO-
B.0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-)
C.25 ℃时,pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则二者消耗的体积是:V(盐酸)>V(氨水)
D.0.1mol/L的NaHCO3溶液中:c(Na+)+ c(H+)=c(HCO3-)+c(OH-)+c(CO32-)
下列叙述中正确的是
| A.糖类不一定都是高分子化合物,但水解产物相同 |
| B.甲苯能使酸性高锰酸钾溶液褪色,证明甲苯分子中存在单双键交替的结构 |
| C.利用粮食酿酒经过了由淀粉→葡萄糖→乙醇的化学变化过程 |
| D.甲醇、乙二醇(HOCH2CH2OH)互为同系物 |
下列实验操作、现象与结论对应关系正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
向盛有Fe(NO3)2溶液的试管中加入0.1mol/L H2SO4溶液 |
试管口出现红棕色气体 |
溶液中NO3-被Fe2+还原为NO2 |
| B |
向饱和Na2CO3溶液中通入足量CO2 |
溶液变浑浊 |
析出Na2CO3晶体 |
| C |
等体积pH=2的HX和HY两种酸分别与足量的铁反应,排水法收集气体 |
HX放出的氢气多且反应速率快 |
HX酸性比HY弱 |
| D |
先向2mL0.1mol/LNa2S溶液中滴几滴0.1mol/LZnSO4溶液,再加入几滴0.1mol/LCuSO4溶液 |
开始有白色沉淀生成;后又有黑色沉淀生成 |
Ksp(ZnS)<Ksp(CuS) |
下列条件下可能大量共存的离子组是
| A.某无色溶液中:NH4+、Na+、Cl-、MnO4- |
| B.常温下由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Na+、K+、SO32-、CO32- |
| C.在c(H+)=1×10-13mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3- |
| D.在pH=1的溶液中:K+、Mg2+ SiO32- SO42- |