I、超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术处理尾气,化学方程式为2NO + 2CO 2CO2 + N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
2CO2 + N2,为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表:
| 时间/s |
0 |
1 |
2 |
3 |
4 |
5 |
| c(NO)/mol·L-1 |
1.00×10-3 |
4.50× 10-4 |
2.50×10-4 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
| c(CO)/mol·L-1 |
3.60×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
请回答(均不考虑温度变化对催化效率的影响):
(1)若上述反应的平衡常数K,随温度增高而减小,则反应的ΔH 0(填“>”、“<”或“=”)。
(2)前2s内的平均反应速度v (N2)= 。
(3)该温度下,反应的平衡常数K= 。
II、甲醇空气燃料电池(酸性电解质溶液)的工作原理如下图一所示。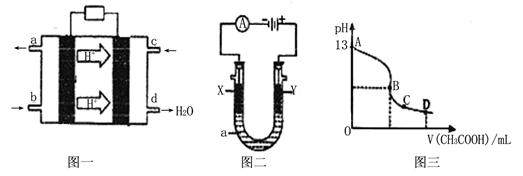
(1)该电池正极的电极反应式为 。
(2)以上述电池为电源,构成图二电解池 ,其中X、Y为石墨,a为KCl溶液,写出电解总反应的离子方程式 。
(3)常温时,按“(2)”电解一段时间后,取25mL上述电解后的溶液,滴加0.2mol/L的醋酸溶液,滴加过程的pH变化如图三所示,则C点对应溶液中各离子浓度的大小关系为(忽略电解后溶液中的其他成分,只考虑其中的碱与加入的酸 ) 。
 已 知C分子结构中只含有一种氢。F为高分子化合物,结构为:
已 知C分子结构中只含有一种氢。F为高分子化合物,结构为: ,其他物质转化关系如下:
,其他物质转化关系如下:
乙苯+Cl2———→ A ———→ B —
⑤ F
C + Br2——③→ D ———→ E —
(1) C的结构简式是:,名称为:E的键线式为:
(2)框图中属于取代反应的是(填数字代号):
(3)写出②反应进行所需条件:
(4)写出反应④的化学方程式:
有机物键线式结构的特点是以线示键,每个折点和线端点处表示有一个碳原子,并以氢补足四价,C、H不表示出来。降冰片烷立体结构如图所示: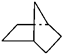
(1)写出其分子式。
(2)当降冰片烷发生一氯取代时,能生成种沸点不同的产物。
(3)根据降冰片烷的键线式结构,请你判断:降冰片烷属于。
a.环烷烃 b.饱和烃 c.不饱和烃 d.芳香烃
(4)降冰片烷具有的性质是。
a.能溶于水b.能燃烧c.能使酸性高锰酸钾溶液褪色
d.能发生加成反应 e. 能发生取代反应 f. 常温常压下为气体
有机化学中的反应类型较多,将下列反应归类(填序号)。
①由乙炔制氯乙烯②乙烷在空气中燃烧
③乙烯使溴的四氯化碳溶液褪色④二甲苯使酸性高锰酸钾溶液褪色
⑤由乙烯制聚乙烯⑥甲烷与氯气在光照的条件下反应
⑦由异戊二烯制橡胶⑧甲苯和浓硝酸浓硫酸100℃条件下反应
其中属于取代反应的是_________;属于氧化反应的是_______;属于加成反应的是_______;属于加聚反应的是________。写出⑧的反应方程式
(6分)150℃时,只含C、H、O三种元素的有机物A8.8g在一定量的O2中燃烧,生成的混合气体缓慢通过盛有足量无水CuSO4的干燥管,干燥管中的固体增重10.8g,剩余的气体通入盛有足量澄清石灰水的试剂瓶,试剂瓶中的物质增重8.8g,最后的气体缓慢通过盛有灼热CuO的硬质试管,硬质试管中的物质质量减少4.8g。请通过计算和分析回答下列问题:
⑴写有机物的分子式▲
⑵本题中,A和O2反应的化学方程式为▲;
⑶若A的结构满足下列条件:能和Na反应但不能和NaOH反应;能进行催化氧化但不能发生消去反应。则A的结构简式为▲;
(12分)丁烷在一定条件下裂解可按两种方式进行:
C4H10 C2H6+C2H4, C4H10
C2H6+C2H4, C4H10 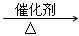 CH4+C3H6。
CH4+C3H6。
下图是某化学兴趣小组进行丁烷裂解的实验流程 。(注:CuO能将烃氧化成CO2和H2O,G后面装置与答题无关,省略)
。(注:CuO能将烃氧化成CO2和H2O,G后面装置与答题无关,省略)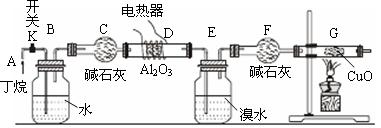
按上图连好装置后, 需进行的实验操作有: ①给D、 G装置加热; ②检查整套装置的气密性; ③排出装置中的空气等 ……
⑴这三步操作的先后顺序依次是____▲_____。
⑵氧化铝的作用是___▲_,写出甲烷与氧化铜反应的化学方程式▲
⑶B装置所起的作用是____________▲______。
⑷若对E装置中的混合物(溴水足量), 再按以下流程实验: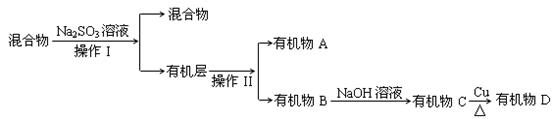 ①操作I、操作II分别是 ▲、▲
①操作I、操作II分别是 ▲、▲
②已知D的氢核磁共振谱图上只有一种峰,则D的结构简式▲
③Na2SO3溶液的作用是▲
(5 )假定丁烷完全裂解,当(E+F)装置的总质量比反应前增加了0.7 g, G装置的质量减少了1.76 g,则丁烷的裂解产物中甲烷和乙烷的物质的量之比n (CH4) : n (C2H6) =___▲___(假定流经D、G装置中的气体能完全反应)
)假定丁烷完全裂解,当(E+F)装置的总质量比反应前增加了0.7 g, G装置的质量减少了1.76 g,则丁烷的裂解产物中甲烷和乙烷的物质的量之比n (CH4) : n (C2H6) =___▲___(假定流经D、G装置中的气体能完全反应)