某化工厂排出的废液中含有 和
和 。为了减少废液对环境的污染,并回收银和铜,某化学小组同学设计了如下方案进行实验:
。为了减少废液对环境的污染,并回收银和铜,某化学小组同学设计了如下方案进行实验:
试回答:
⑴加入的固体a是(写化学式) 。
⑵固体乙的成分有
⑶步骤①中将滤液1与固体甲分离的操作名称是
⑷写出步骤②中发生反应的化学方程式
某化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行探究,查阅资料如下:
1、该牙膏摩擦剂由碳酸钙、氢氧化铝组成;
2、牙膏中其它成分遇到盐酸无气体生成;
3、碱石灰的主要成分为生石灰和氢氧化钠固体。
利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定B中生成的BaCO3沉淀的质量,以确定碳酸钙的质量分数。请回答下列问题:
(1)B中反应生成BaCO3的化学方程式是 。
(2)C装置的作用是 。
(3)下列各项措施中,不能提高测定准确度的是 (填序号)。
| A.在加入盐酸之前,应排净装置内的CO2气体 |
| B.滴加盐酸不宜过快 |
| C.在A~B之间增添盛有浓硫酸的洗气装置 |
| D.在A~B之间增添盛有饱和碳酸氢钠溶液的洗气装置 |
(4)有同学认为该装置测定出来的碳酸钙质量分数会偏低,他的理由是
,解决方法是 。
(5)某同学认为不必测定B中生成的BaCO3质量,将B中的Ba(OH)2溶液换成浓H2SO4,通过测定C装置反应前后的质量差也可以测定CaCO3的质量分数。实验证明按此方法测定的结果明显偏高,原因是 。
(6)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g 。请计算样品中碳酸钙的质量分数。(写出计算过程)
有下列装置,其中A是气体发生装置,B、C、D、E是气体收集装置,E还可作气体的净化装置(E装置有多个备用)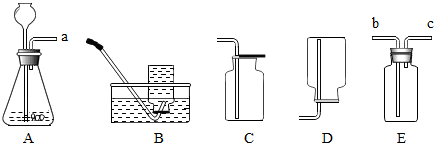
(1)当用大理石和盐酸制取CO2时,选取的收集装置是(填“B”或“C”或“D”)为了得到纯净、干燥的CO2,首先在E装置中注入足量的NaOH溶液来除去HCl,你认为该方法是否恰当并说明理由,然后在另一个E装置中注入浓硫酸,其作用是。
(2)当用过氧化氢溶液和二氧化锰来制取氧气时,A中发生反应的化学方程式为,若a与c相连来收集氧气,还需将装置E。
如图是实验室常用的两种气体制备、收集、净化的多种功能装置.请完成下列各题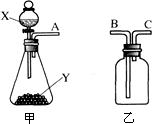
(1)若制备的气体是氢气,且产生的气体中不含酸性杂质气体,则试剂X常用;
(2)若X是过氧化氢溶液,Y是二氧化锰,将装置甲和乙通过A、C相连来制取气体,检查装置气密性后,还须将装置乙;
(3)为测定黄铜(Cu和Zn)中锌的质量分数,某化学小组只用甲装置:称取ag黄铜与足量的盐酸反应。欲计算黄铜中锌的质量分数,还须测定的数据有。
某化学兴趣小组利用下列装置进行O2、CO2的实验室制法和有关性质的研究。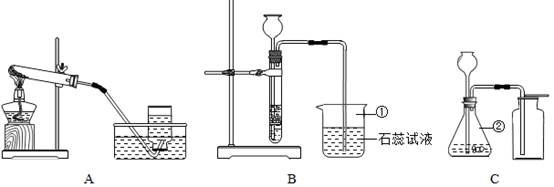
(1)写出下列编号仪器的名称:①__________ ②__________。
(2)甲同学要用KMnO4固体来制取O2,应选用上图中的______装置(填编号),该反应的化学方程式是_____________________。当O2收集满并取出集气瓶后,停止该实验的正确操作步骤是先_________后___________。
(3)乙同学用浓盐酸和大理石在B装置中反应,制取CO2并检验其有关性质,观察到烧杯中紫色石蕊试液变红。对这一变化的合理解释是_______(填序号)
A、产生的CO2直接使石蕊试液变红;
B、产生的CO2与水反应生成H2CO3使石蕊试液变红;
C、挥发出的氯化氢溶于水使石蕊试液变红。
(4)丙同学用C装置制取了一瓶无色无味的气体(纯净物),你推测该气体可能是________,试用最简便的方法证实你的推测__________________。
根据下图所示装置回答问题(装置图用序号表示):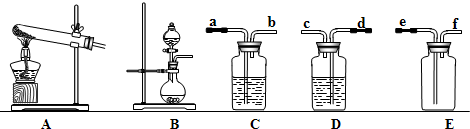
(1)双氧水(H2O2)是一种无色液体,可发生如下反应:2H2O2 2H2O + O2↑,在实验室利用此反应制取氧气时,应选用的气体发生装置是。
2H2O + O2↑,在实验室利用此反应制取氧气时,应选用的气体发生装置是。
(2)实验室用大理石和盐酸反应制取二氧化碳,在生成的气体中常混有少量氯化氢和水蒸气,C装置用于除掉水蒸气,可选用做干燥剂(填名称)。利用D装置除掉氯化氢时,选择的试剂是饱和NaHCO3溶液,已知NaHCO3与HCl反应生成NaCl、H2O、CO2,请写出该反应的化学方程式。
(3)将制取二氧化碳的装置按发生、净化和收集的顺序进行连接,生成的气体通过净化装置导管口的先后顺序是(填导管接口序号)。