某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
| 阳离子 |
K+ Cu2+ Fe3+ Fe2+ Al3+ |
| 阴离子 |
Cl- CO32- NO3- SO42- SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是 (写离子符号)。
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式是_________________________。
(3)将Ⅲ中所得红棕色气体通入水中,气体变无色,所发生的化学方程式为_______________________________________________________________。
(4)甲同学最终确定原溶液中所含阳离子是 ,阴离子是
。(写离子符号)
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重, 得
到的固体质量为 。
下图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格:
 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
① |
② |
③ |
④ |
||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
(1)在这10种元素中,化学性质最不活泼的元素是(填元素符号), 金属性最强的元素是(填元素名称),最活泼的非金属单质是(化学式),元素⑨对应的离子结构示意图为_。
(2)给出的第二周期的几种元素中,原子半径最大的是(填元素符号)。
(3)元素③与⑧的气态氢化物中较稳定的物质是(填该物质的电子式)。
(4)元素⑤与⑥的最高价氧化物的水化物的碱性更强的物质是(填化学式)。
(5)元素③与⑦能以键(填化学键类型)结合成晶体(填晶体类型)。
下列是部分短周期中第二、第三周期元素的原子半径及主要化合价。
| 元素代号 |
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
| 原子半径(nm) |
0.186 |
0.160 |
0.152 |
0.143 |
0.110 |
0.099 |
0.075 |
0.074 |
| 主要化合价 |
+1 |
+2 |
+1 |
+3 |
+5、 -3 |
+7、 -1 |
+5、 -3 |
-2 |
回答下列问题:⑧在元素周期表中的位置是(周期、族)。
在这8种元素的最高价氧化物的水化物中,酸性最强的是(填化学式)。
①元素和⑥元素形成化合物的电子式是 。
写出①和④的最高价氧化物对应水化物反应的离子方程式:
。②、④、⑤、⑥的简单离子的离子半径由大到小的顺序是:>>>。(填离子符号)
比较⑤、⑦气态氢化物的稳定性>(用分子式表示)
下列叙述中不正确的是(填字母)。
| A.③、④处于不同周期 |
| B.⑥在同主族元素中非金属性最强 |
| C.⑤元素与⑦元素两者核电荷数之差是8 |
| D.①与⑧形成的化合物只含有离子键 |
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑨九种元素在周期表中的位置。
| 族周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
⑤ |
⑥ |
||||||
| 3 |
① |
③ |
④ |
⑦ |
⑨ |
|||
| 4 |
② |
⑧ |
请回答:这九种元素分别是①(填元素符号,下同)、②、④、⑤、⑥、⑧、其中化学性质最不活泼的是。
在①、②、③三种元素的氧化物对应的水化物中,碱性最强的是(填化学式)。
⑥元素的氢化物是 (填化学式),该氢化物在常温下与②发生反应的化学方程式为 。
⑧元素与①元素形成的化合物是(填化学式),高温下灼烧该化合物时,火焰呈色。
某同学做元素性质递变规律实验时,
设计了一套实验方案,记录了有关实验现象。
| 实验步骤 |
实验现象 |
| ① 将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②将一小块金属钠放入滴有酚酞溶液的冷水中 |
B.有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 |
C.反应不十分剧烈;产生无色气体 |
| ④将铝条投入稀盐酸中 |
D.剧烈反应,迅速产生大量无色气体 |
请帮助该同学整理并完成实验报告。实验目的:研究元素性质递变规律。
实验内容:(填写与实验步骤对应的实验现象的编号)
| 实验内容 |
① |
② |
③ |
④ |
|
| 实验现象(填A-D) |
写出实验①、②对应化学方程式
实验①,
实验②。实验结论: 。
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。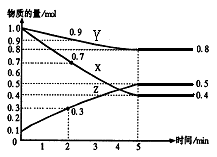
由图中的数据分析,该反应的化学方程式为;
反应开始至2min、5min时Z的平均反应速率分别为、;
开始min后,反应达到最大限度。