研究氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s) NaNO3(s)+ClNO(g),K1 △H1<0 (Ⅰ)
NaNO3(s)+ClNO(g),K1 △H1<0 (Ⅰ)
2NO(g)+Cl2(g) 2ClNO(g),K2 △H2<0 (Ⅱ)
2ClNO(g),K2 △H2<0 (Ⅱ)
(1)4NO2(g)+2NaCl(s) 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示).
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K= (用K1、K2表示).
(2)为研究不同条件对反应(Ⅱ)的影响,在恒温条件下,向2L恒容密闭容器中加入0.2mol NO和0.1mol Cl2,10min时反应(Ⅱ)达到平衡,测得10min内v(ClNO)=7.5×10﹣3mol·L﹣1·min﹣1,则平衡后n(Cl2)= mol,NO的转化率α1= .其他条件保持不变,反应(Ⅱ)在恒压条件下进行,平衡时NO的转化率α2 α1(填“>”“<”或“=”),平衡常数K2 (填“增大”“减小”“不变”).若要使K2减小,可采取的措是 .
某中学课外兴趣小组用惰性电极电解饱和食盐水(含少量Ca2+ 、Mg2+)作系列探究,装置如图所示:
(1)电解时,甲同学发现电极a附近溶液出现浑浊,请用离子方程式表示原因________________________________________________________________________。
(2)一段时间后,你认为C中溶液可能出现的现象是________________________,请用离子方程式表示原因______________________________________。
(3)实验结束后,乙同学将A中的物质冷却后加入到H2S溶液中发现有气泡出现,但加入到稀盐酸中却没有任何现象。请用化学方程式和简要的文字解释原因:________________________________________________________________________________________________________________________________________________。
(4)随着反应的进行,兴趣小组的同学们都特别注意到D中溶液红色逐渐褪去。他们对溶液红色褪去的主要原因提出了如下假设,请你完成假设二。
假设一:B中逸出的气体与水反应生成的物质有强氧化性,使红色逐渐褪去;
假设二:___________________________________________________。
(5)请你设计实验验证上述假设一,写出实验步骤及结论:________________________________________________________________________________________________________________________________________________________。
(1)将等物质的量的KI和CuCl2溶于水,用惰性电极电解,该电解反应可分为________个阶段(表格不一定填满,若不够还可以自行添加)。
| 阶段 |
相当于电解什么溶液 |
离子方程式 |
| ① |
||
| ② |
||
| ③ |
||
| ④ |
||
| ⑤ |
(2)画出过程中溶液pH随时间变化的曲线(假定生成的Cl2全部逸出)。
用惰性电极电解NaCl与NaHCO3的混合溶液,测得溶液的pH变化如图所示。
(1)在0→t1时间内,两个电极上的电极反应式为:
阳极:________________________________________________________________________;
阴极:________________________________________________________________________。
(2)用离子方程式表示0→t1时间内,溶液pH升高比较缓慢的原因:____________________________________________________________________________。
电化学原理在工业生产中有着重要的作用,请利用所学知识回答有关问题。
(1)用电解的方法将硫化钠溶液氧化为多硫化物的研究具有重要的实际意义,将硫化物转变为多硫化物是电解法处理硫化氢废气的一个重要内容。如图,是电解产生多硫化物的实验装置:
①已知阳极的反应为(x+1)S2-=Sx+S2-+2xe-,则阴极的电极反应式是________________________________________________________________________。
当反应转移x mol电子时,产生的气体体积为____________(标准状况下)。
②将Na2S·9H2O溶于水中配制硫化物溶液时,通常是在氮气气氛下溶解。其原因是(用离子反应方程式表示):___________________________________________________。
(2)MnO2是一种重要的无机功能材料,制备MnO2的方法之一是以石墨为电极,电解酸化的MnSO4溶液,阳极的电极反应式为______________________。现以铅蓄电池为电源电解酸化的MnSO4溶液,如图所示,铅蓄电池的总反应方程式为_______________________________________________,当蓄电池中有4 mol H+被消耗时,则电路中通过的电子的物质的量为________,MnO2的理论产量为________g。
(3)用图电解装置可制得具有净水作用的FeO42-。实验过程中,两极均有气体产生,Y极区溶液逐渐生成FeO42-。
①电解过程中,X极区溶液的pH________(填“增大”“减小”或“不变”)。
②电解过程中,Y极发生的电极反应为Fe-6e-+8OH-=FeO42-+4H2O和________________________________________________________________________,
若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少________g。
化学能与电能之间的相互转化与人类的生活实际密切相关,在生产、生活中有重要的应用,同时也是学生形成化学学科素养的重要组成部分。
(1)熔融状态下,钠的单质和氯化亚铁能组成可充电电池,如图9-8工作原理示意图,反应原理为2Na+FeCl2 Fe+2NaCl,该电池放电时,正极反应式为________________________________________________________________________;
Fe+2NaCl,该电池放电时,正极反应式为________________________________________________________________________;
充电时,____________(写物质名称)电极接电源的负极;该电池的电解质为________。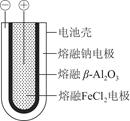
(2)某同学用铜片、石墨作电极电解一定浓度的硫酸铜溶液,工作原理示意图如图所示,一段时间停止通电取出电极。若在电解后的溶液中加入0.98 g氢氧化铜粉末恰好完全溶解,经测定所得溶液与电解前完全相同。请回答下列问题: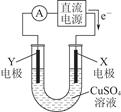
①Y电极材料是________,发生________(填“氧化”或“还原”)反应。
②电解过程中X电极上发生的电极反应式是_______________________________________________________________________。
③如在电解后的溶液中加入足量的小苏打,充分反应后产生气体在标准状况下所占的体积是__________。