金属钛(Ti)因为具有许多神奇的性能越来越引起人们的关注,被誉为“未来金属”。常温下钛不和非金属、强酸反应,加热至红热时,能与常见的非金属反应。工业上由钒钛磁铁矿经“选矿”得到的钛铁矿(主要成分为FeTiO3)制取金属钛的主要工艺过程如下: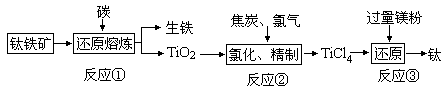
(1)从金属矿石中提炼金属一般需要经过三个阶段,上述工艺溶度积中涉及的有矿石中金属元素的还原、矿石的富集、金属的精炼;没有涉及的一个阶段是______________;生铁实际上属于铁______等元素形成的合金。若生产中碳的氧化产物主要为一种可燃性气体,请写出反应②的化学方程式__________________________。
(2)生产中碳除了用还原剂还原还原金属矿物外,还有一个重要作用是______________;反应③是在氩气的环境中进行,目的是_____________________,如何从反应③后的固体中获得金属钛_______________________________。
(3)已知在氯化过程中还有一种副产物VOCl3生成,实际生产中常在409K时用铜还原VOCl3,得到不溶于TiCl4的VOCl2,当有1molCu参加反应时转移的电子数为NA,试写出该反应的化学方程式为___________________。
A—J是中学化学中常见的物质,它们之间的转化关系如下框图所示(部分产物已略去)。已知A是一种高熔点物质,J是一种红褐色沉淀。
请回答下列问题:
(1)A的化学式为,在水中的溶解性(选填“易溶”、“可溶”、“难溶”)。
(2)H溶液中通入过量的CO2,其反应的离子方程式是。
G→J的化学方程式为。
反应的现象是。
(3)D物质恰好溶于一定量的稀盐酸后,用合适的化学用语表示所得溶液显酸性的原因。
四种短周期元素的性质或结构信息如下表。请根据信息回答下列问题。
| 元素 |
T |
X |
Y |
Z |
| 性质 结构 信息 |
人体内含量最多的元素,且其单质是常见的助燃剂。 |
单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼。 |
单质质软、银白色固体、导电性强。 单质在空气中燃烧发出黄色的火焰。 |
第三周期元素的简单离子中半径最小 |
(1)写出元素T的离子结构示意图;写出元素X的气态氢化物的电子式;离子半径比较:Y离子Z离子(填“>”或“<”)。
(2)写出Z原子的核外电子排布式。
(3)Z的最高价氧化物对应水化物的电离方程式。
(4)元素T与氟元素相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是
a.常温下氟气的颜色比T单质的颜色深
b.氟气与T的氢化物剧烈反应,产生T的单质
c.氟与T形成的化合物中T元素呈正价态
d.比较两元素的单质与氢气化合时得电子的数目
二氧化硫和氮氧化物(NOx)对大气污染日趋严重,研究消除大气污染的方法是化学工作者的重要课题,目前有很多种方法消除大气污染。
(1)可利用甲烷催化还原NOx的方法处理NOx,反应如下:
CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g);△H= -574 kJ·mol-1
CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g);△H= -1160 kJ·mol-1
则CH4(g)+2NO2(g)= N2(g)+CO2(g)+2H2O(g);△H=;
(2)降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g);△H<0。
N2(g)+2CO2(g);△H<0。
若在一定温度下,将2molNO、1molCO充入1L固定容积的容器中,15分钟后达到平衡,反应过程中各物质的浓度变化如图甲所示,则平衡常数K=(小数点后保留3位);
①若保持温度不变,20min时再向容器中充入CO气体0.6mol,平衡将移动(填“向左”、“向右”或“不”);
②若保持温度不变,20min时向原平衡容器中充入CO、N2各0.6mol,平衡将移动(填“向左”、“向右”或“不”);
③20min时,若改变反应条件,导致N2浓度发生如图所示的变化,则改变的条件可能是
(填字母);
| A.加入催化剂 | B.降低温度 | C.缩小容器体积 | D.增加CO2的量 |
(3)利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-,从而实现对SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ =4Fe3+ + 2H2O,则另一反应的离子方程式为;
下面a~e是中学化学实验中常见的几种定量仪器:
(a)量筒(b)容量瓶(c)滴定管 (d)托盘天平 (e)温度计
(1)无“0”刻度的是(填写编号)。
(2)下列操作合理的是(填字母)
| A.用25mL碱式滴定管量取20.00mLNaHCO3 |
| B.用托盘天平准确称量10.20克碳酸钠固体 |
| C.用100mL量筒量取3.2mL浓硫酸 |
| D.配制1 mol·L–1的氢氧化钠溶液475mL选用500mL容量瓶 |
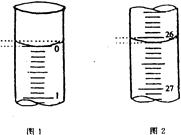
(3)某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液,若滴定开始和结束时,酸式滴定管中的液面如上图所示:则所用盐酸溶液的体积为mL。
(4)图甲表示10 mL量筒中液面的位置,A与B,B与C刻度间相差1 mL,如果刻度A为4,量筒中液体的体积为mL;图乙表示25 mL酸式滴定管中某酸的体积,D与E 之间的刻度差为1 mL,如果刻度D为4,则该酸式滴定管中液体体积的读数为mL。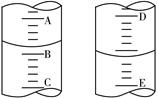
图甲图乙
(1)25℃时,某NaCl溶液中c(Cl–)=1×10-4 mol·L–1,则该溶液中c(Na+)∶c(OH-)=
(2)25℃时,将0.1 mol·L–1NaOH溶液与0.06 mol·L–1的H2SO4溶液等体积混合(忽略混合后体积的变化),求所得溶液的pH=。25℃时,pH值为8的NaOH溶液与pH值为10的NaOH溶液等体积混合后,溶液中氢离子浓度最接近。
(3)25℃时,下列四种溶液中,①pH=0的盐酸②0.1 mol·L–1的盐酸③0.01 mol·L–1的NaOH溶液④pH=11的NaOH溶液,由水电离生成氢离子浓度之比①︰②︰③︰④是:(填字母)
| A.1︰10︰100︰1000 | B.0︰1︰12︰11 |
| C.14︰13︰12︰11 | D.14︰13︰2︰3 |
(4)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11,
①则该温度下水的Kw= 。
②在该温度下测得某溶液pH=3,则该溶液中c(H+)∶c(OH-)=________。
③该温度下将pH=2的盐酸和pH=11的氢氧化钠溶液等体积混合,pH=______________
(5) 纯水中c(H+)=5.0×10–7 mol·L–1,则此时纯水中的c(OH–) =;若温度不变,滴入稀硫酸使c(H+)=5.0×10–3 mol·L–1,则c(OH–) =;在该温度时,往水中滴入NaOH溶液,溶液中的c(OH–)=5.0×10–2 mol·L–1,则溶液中c(H+)=。