已知A、B、R、D都是周期表中前四周期的元素,它们的原子序数依次增大。其中A元素基态原子第I电离比B元素基态原子的第I电离能大,B的基态原子的L层、R基态原子的M层均有2个单电子,D属于VIII族原子序数最小的元素。
(1)写出基态D原子的电子排布式 。
(2)已知高纯度R在现代信息技术与新能源发展中具有极为重要的地位、工业上生产高纯度R过程如下:
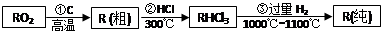
写出③的反应方程式_______________________________,已知RHCl3的沸点是31.5℃,则该物质的晶体类型是____________,中心原子的轨道杂化类型为_________,该物质的空间构型是_________。
(3)A的第I电离能比B的第I电离能大的原因是____________________,A、B两元素与R形成的共价键中,极性较强的是_________。A、B两元素间能形成多种二元化合物,其中与A3-互为等电子体的物质化学式为___________
某校化学研究性学习小组对氯气的性质和用途进行了调查分析,了解了氯气能应用 于衣物漂白、水体的杀菌和消毒的原理。
(1) 氯气溶于水可用于漂白、消毒的原因是_______,反应的离子方程式为_______ ;
(2) 通常使用漂白液(NaClO溶液)作漂白剂而不用氯气的理由是_____(写出一项即可);
(3) 在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应 (发生的反应均为放热反应)。最终生成物中含有Cl-、 ClO-、ClO3-三种含氯元素的离子,其中ClO-、ClO3-两种离 子的物质的量(n)与反应时间(t)的变化曲线如下图所示。
①O-t1时间内,Ca(OH)2与Cl2发生反应的化学方程式为_______;
②t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为_______
③该石灰乳中含有Ca(OH)2的质量是_______g;
氧化还原滴定与酸碱中和滴定一样是化学实验室常用的定量测定方法。某氧化还 原滴定的反应体系中有反应物和生成物共六种,
 ,其中H2SO3的还原性最强,KMnO4的氧化性最强。对此反应体系:
,其中H2SO3的还原性最强,KMnO4的氧化性最强。对此反应体系:
(1) 被氧化的元素是_______;发生还原反应的过程是________→______。
(2) 请用这六种物质组织一个合理的化学反应,写出它的离子方程式:_______
(3) 反应中H2SO4是_______ (填编号)
A,氧化剂 B.氧化产物 C.生成物 D.反应物
(4) 当有20mL 0.1mol/L的氧化剂参加反应时,电子转移数目是_______ 。
(5) 用标准KMnO4溶液滴定H2SO3时,滴定终点时颜色变化是_______。
(6) 滴定过程中.下列图像所表示的关系正确的是_______(填编号)。
在10mL含有AlO2-离子的溶液中逐滴加入1mol/L的盐酸,所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示。
问: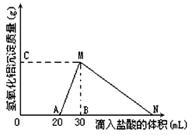
(1)此溶液中同时含有____mol___离子;
(2) C(或M)点的纵坐标为0.78,则c(AlO2-)为
(3) 点B的横坐标为30,则到点N处滴入的HCl溶液体积为mL
合成氨对农业生产及国防建设均具有重要意义。
N2(g)+3H2(g)  2NH3(g) △H =" -92" kJ·mol-1
2NH3(g) △H =" -92" kJ·mol-1
(1)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是_______(填序号)。
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(2)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题:
① 表示N2的浓度变化的曲线是(选填曲线代号“A”、“B”或“C”)。
② 前25 min 内,用H2的浓度变化表示的化学反应平均速率是。
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K = (计算结果可用分数表示)。
若升高温度,该反应的平衡常数值将_______(填“增大”、“减小”或“不变”)。
(Ⅰ) “亮菌甲素”结构简式如右图,是黄色或橙黄色结晶粉末,几乎不溶于水,辅料丙二醇(C3H8O2)溶成针剂用于临床。该药为利胆解痉药,适用于急性胆囊炎、慢性胆囊炎急性发作及慢性浅表性胃炎等。
(1)写出“亮菌甲素”的分子式_________________。
(2)1mol 亮菌甲素最多能和_______mol H2发生反应,该反应类型是_______反应。
(3)1mol“亮菌甲素”最多与mol NaOH反应。
(Ⅱ)含碳、氢、氧元素的下列有机物分子式通式:
A.Cn(H2O)m B.(C2H3)n(H2O)mC.(C2H)n(H2O)m D.(CH)n(H2O)mE.(C2O)n(H2O)m F.(CO)n(H2O)m
(1)若充分燃烧某类有机物,消耗氧气的体积与生成二氧化碳的体积之比为5∶4(相同条件下),则该类有机物分子式通式是上述各式中的_________(填代号)。
(Ⅱ)(1)消耗的氧气和生成二氧化碳的体积比5:4,1个C消耗1个O2,4个C消耗4个O2,4个H消耗1个O2,所以,C:H=4:4因为需消耗5O2,产生4CO2,根据元素守恒可知,有机物中含有2个O,C:H:O=4:4:2=2:2:1,表示为(CH)n(H2O)m,故选D。
(2)若某有机物分子式符合上述C的通式,其相对分子质量为136,写出该有机物的分子式为____;若该有机物属于酯类且分子中含有苯环,则其可能的同分异构体有___种。