合成氨对农业生产及国防建设均具有重要意义。
N2(g)+3H2(g)  2NH3(g) △H =" -92" kJ·mol-1
2NH3(g) △H =" -92" kJ·mol-1
(1)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是_______(填序号)。
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(2)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题:
① 表示N2的浓度变化的曲线是 (选填曲线代号“A”、“B”或“C”)。
② 前25 min 内,用H2的浓度变化表示的化学反应平均速率是 。
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K = (计算结果可用分数表示)。
若升高温度,该反应的平衡常数值将_______(填“增大”、“减小”或“不变”)。
过氧化氢(H2O2)俗名双氧水,医疗上可做外科消毒剂。
(1)H2O2的电子式为______。
(2)将双氧水加入经酸化的高锰酸钾溶液中,溶液的紫色消褪了,此时双氧水表现出_______性。若MnO4-的产物为Mn2+,该反应的离子方程式为______。
(3)久置的油画,白色部位(PbSO4)常会变黑(PbS),用双氧水揩擦后又恢复原貌,有关的反应方程式为______。此时双氧水表现出______性。
有黑色和黄色两种固体物质A和B,它们都是由相同的两种元素组成.A与稀 作用产生气体C,B在充足的空气中燃烧生成气体D,C和D的水溶液都呈酸性,并都能使溴水褪色,且C和D混合后不久有固体物质E生成.
作用产生气体C,B在充足的空气中燃烧生成气体D,C和D的水溶液都呈酸性,并都能使溴水褪色,且C和D混合后不久有固体物质E生成.
(1)由A生成C的离子方程式是________________________
(2)B燃烧生成D的化学方程式是________________________
(3)C和D混合后反应的化学方程式是________________________
在一定条件下,二氧化硫和氧气发生如下反应:
2SO2(g)+ O2(g)  2SO3(g);ΔH<0
2SO3(g);ΔH<0
(1)写出该反应的化学平衡常数表达式K=______。
(2)降低温度,该反应K值_______,二氧化硫转化率_______,化学反应速率________。(以上均填增大、减小或不变)
(3)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图所示,反应处于平衡状态的时间是_________。
(4)据图判断,反应进行至20min时,曲线发生变化的原因是_________ (用文字表达);10 min到15min的曲线变化的原因可能是_________ (填写编号)。
| A.加了催化剂 | B.缩小容器体积 |
| C.降低温度 | D.增加SO3的物质的量 |
在密闭容器中,将0.020 mol·L-1 CO和0.020 mol·L-1 H2O(g)混合加热到773 K 时,达到下列平衡CO(g)+H2O(g) CO2(g)+H2(g),K=9,求CO的转化率。
CO2(g)+H2(g),K=9,求CO的转化率。
在恒温时,向某密闭容器中通入2 mol X和1 mol Y气体,发生如下反应:2X(g)+Y(g) 2Z(g),压强一定时,测得在平衡时Z的体积分数为0.4。
2Z(g),压强一定时,测得在平衡时Z的体积分数为0.4。
(1)与上述平衡保持同温、同压,若向密闭容器中通入4 mol X(g)和2 mol Y(g),达到平衡,则Z的体积分数为_______;平衡时,气体X的体积分数为_______。
(2)与上述平衡保持同温、同压,若向密闭容器中通入X(g)和Y(g)的物质的量分别记为n(X)=m、n(Y)=n,并满足平衡时Z的体积分数为0.4,则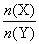 的取值范围为_______。
的取值范围为_______。