X、Y、Z、W为按原子序数由小到大排列的四种短周期元素,已知:
①X元素原子价电子排布式为ns2np2,且原子半径是同族元素中最小的。
②Y元素是地壳中含量最多的元素;W元素的电负性略小于Y元素,在W原子的电
子排布中,p轨道上只有1个未成对电子。
③Z+与Y 2-具有相同的电子层结构;
请回答:
(1)Z2Y2的电子式为 ,含有的化学键类型为 ,Z2Y2为 晶体。
(2)X、Y、Z三种元素所形成的常见化合物的名称为 ;XY2的结构式为 ,分子的立体构型为 。
(3)X、Y、Z、W四种元素所形成的单质中,熔点最高、硬度最大的是 (填名称);晶体ZW的熔点比晶体XW4明显高的原因是 。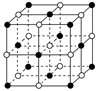
(4)ZW晶体的结构示意图如图。已知:ZW晶体的密度为ρ,摩尔质量为M,阿伏伽德罗常数为NA,则ZW晶体中两个最近的Z离子中心间的距离d可以表示为d= 。
(18分) 完成下列空白。
(1)“辛烷值”用来表示汽油的质量,汽油中异辛烷的爆震程度最小,将其辛烷值标定为100,下图是异辛烷的球棍模型,则异辛烷的系统命名为_________ ___ _。
(2)写出下列反应的化学方程式
①2,5-二甲基-2,4-己二烯与足量氢气加成:;
②2-甲基-2-丁烯加聚反应_________________
③甲苯在一定条件下生成三硝基甲苯:________________________________
④实验室制备乙烯:________________________________
(3)烯烃与溴化氢、水加成时,产物有主次之分,例如:
CH2=CHCH3+HBr → CH3CHBrCH3+CH3CH2CH2Br
(主要产物) (次要产物)
A是一种不对称烯烃,与HBr加成时,生成的主要产物为B,且B中仅含有4个碳原子、1个溴原子、1种氢原子。则B的结构简式为 ,A的结构简式为
在短周期元素中,A元素M电子层上有7个电子,C元素与A元素同主族,B元素与A元素位于同一周期,B元素的原子最外电子层只有1个电子。
(1)画出B元素的原子结构示意图______________。
(2)C、B两元素形成化合物的化学式是___________,其形成过程用电子式表示为______________。
(3)写出B的两种氧化物的电子式:、。
(4)比较A元素的氢化物与C元素的氢化物稳定性:(填化学式及“<、>或=”)原因为:。
(9分)把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol·L-1盐酸溶液的烧杯中,该铝片与盐酸反应产生氢气的速率与反应时间的关系可用下图所示的坐标曲线来表示,回答下列问题:
(1)曲线O→a段不产生氢气的原因,用化学方程式解释为。
(2)曲线b→c段产生氢气的速率增加较快的主要原因是。
(3)向溶液中加入下列物质,能加快上述化学反应速率的是 。
| A.蒸馏水 |
| B.改用铝粉 |
| C.饱和氯化钠溶液 |
| D.浓盐酸 |
E.少量硫酸铜溶液
(12分)(1)将锌片和银片用导线相连浸入稀硫酸中组成原电池。该电池中负极发生________反应(填“氧化”或“还原”);溶液中的H+移向________(填“正极”或“负极”)材料。
(2)电能是现代社会应用最广泛的能源之一。下图所示的原电池装置中,其负极是__________,正极上能够观察到的现象是____________________________,正极的电极反应式是______________。原电池工作一段时间后,若消耗锌6.5g,则放出气体_______g。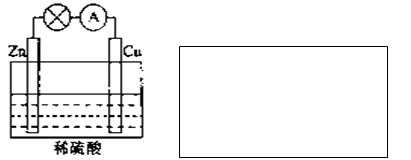
(3)利用下列反应:Fe+2Fe3+=3Fe2+,设计一个化学电池(给出若干导线和一个小灯泡,电极材料和电解液自选):①画出实验装置图;②注明正负极材料和电解质溶液;③标出电子流动方向。
(1)已知断开1 mol N≡N键需要946 kJ的能量,断开1 mol H—H键需要436 kJ的能量,生成1 mol N—H键放出391 kJ的能量,试计算生成2 mol NH3时会________(填“放出”或“吸收”)________kJ能量。
(2)当在相同的条件下向容器中充入1 mol N2和3 mol H2时,它们反应对应的热量________(填“大于”、“等于”或“小于”)你所计算出的值,原因是__________________________。