电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题: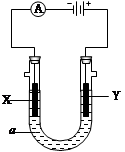
(1)X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 ,
在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,
检验该电极反应产物的方法是 。
③总反应的化学方程式 。
(2)X、Y都是惰性电极,电解CuSO4溶液,当电路中通过0.4mol 电子时,析出铜的同时在另一个电极可得 L O2 (标准状况下)
丙二醇和其他无机原料合成环状化合物D。
(1)请在下列方框内填入合适的化合物的结构简式:
(2)C和水发生加成反应生成B的化学方程式;
(3)D和NaOH水溶液共热的化学方程式;
(4)C属于______类化合物,名称为______。
从煤中可以获得大量的基本化工原料,苯、二甲苯就是通过煤的干馏而获得的。
(1)苯分子中的氢原子数比同碳原子数的烷烃少,人们认为它是一种不饱和烃。请举出能支持这一观点的一个化学反应(用化学方程式表示):
_____________________________________________________________________。
(2)苯不能使溴水褪色,性质又类似于烷烃,任写一个苯发生取代反应的化学方程式:
_____________________________________________________________________。
(3)二甲苯的分子式为________,与二甲苯互为同分异构体的苯的同系物的名称_______
___________________。
(4)1866年凯库勒提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但还有一些问题尚未解决,它不能解释的事实是(填入编号)____________。
| A.苯不能使溴水褪色 | B.苯能与H2发生加成反应 |
| C.溴苯没有同分异构体 | D.邻二溴苯只有一种 |
(5)现代化学认为苯分子中的碳碳键是_______________________________________。
比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射氯乙烷(沸点12.27℃)进行局部冷冻麻醉应急处理。乙烯和氯化氢在一定条件下制得氯乙烷的化学反应方程式是(有机物用结构简式表示)_____________________________,该反应类型是_____________,该反应的原子利用率为_________,决定氯乙烷能用于冷冻麻醉应急处理的具体性质是___________________________________________________。
(1)体积相同,c(H+)相同的盐酸和醋酸溶液分别与足量的颗粒大小相同的锌粒反应,开始时产生氢气的速率,充分反应后产生氢气的量(相同、醋酸的多、盐酸的多),原因是。
(2)在一定量的盐酸溶液中加入足量的锌粒,要使产生氢气的量保持不变,但反应速率加快,可加入晶体,理由是;要使产生氢气的量不变,但反应速率减慢,可加入晶体,理由是。
可供选择的晶体有:
| A.纯碱 | B.烧碱 | C.胆矾 | D.醋酸钠 E.KHSO4 |
浓度为0.1mol/L的8种溶液:①HNO3 ②H2SO4③HCOOH ④Ba(OH)2 ⑤NaOH ⑥CH3COONa ⑦KCl ⑧NH4Cl溶液pH值由小到大的顺序是(填写编号)____________。