将15.6g Na2O2与2.7g Al粉混合后,投入足量的水中,充分反应(设能产生的气体全部放出)。
(1)Na2O2与水反应的化学方程式为 ,15.6g Na2O2在该反应中转移电子的物质的量为 mol。
(2)反应结束时生成的气体在标准状况下为 L。
(3)取a g Na2O2与Al粉组成的混合物,放入适量的水中,固体完全溶解,在标准状况下
放出气体V L,则V的取值范围是 (用含a的代数式表示,结果可不化简)。
将质量相等的铁片和铜片用导线相连浸入500mL硫酸铜溶液中构成如下图的装置。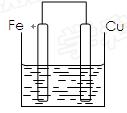
(1)铁片上的电极反应式为,铜片上的电极反应式为,铜片周围溶液会出现的现象。
(2)若2 min后测得铁片和铜片之间的质量差为1.2g,则导线中流过的电子为mo1,该段时间内用硫酸铜表示的平均反应速率为。
(3)若将该装置改为如下图所示的装置也能达到和原装置相同的作用,同时能保证停止使用该装置时反应物不损耗,KCl溶液起沟通两边溶液形成闭合回路的作用,则硫酸铜溶液应该注入(填“左侧”、“右侧”或“两侧”)烧杯中,若2 min内铁片减少了2.8g,则中间U形管中K+的流速是mo1/min。(以上均假设反应过程中溶液体积不变)。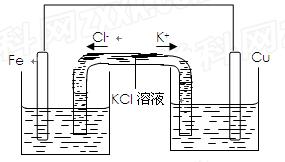
(8分)①1mol有机物HCHO(甲醛)完全燃烧耗O2的物质的量为。
② 1mol有机物CH3COOH完全燃烧耗O2的物质的量为。
1mol有机物CH3COOH完全燃烧耗O2的物质的量为。
③有机物CnHmOc完全燃烧时需要O2的物质的量是该有机物的n倍,则n:m:c=且n、m满足的关系式为。
(8分)①M克CO与足量O2在电火花点火的情况下,两者恰好完全反应后生成的气体通过足量Na2O2粉末后,固体增重克。
②在100℃时,2克H2与足量O2在电火花点火的情况下,两者恰好完全反应后生成的气体通过足量Na2O2粉末后,固体增重克。
③在100℃时,A克CO和H2混合气体与足量O2在电火花点火的情况下,两者恰好完全反应后生成的气体通过足量Na2O2粉末后固体增重恰好为A克,则CO和H2的物质的量的比为。
④在100℃时,容积不变的密闭容器中充入一定量的CH4,O2,Na2O2 在电火花点火的情况下,两者恰好完全反应后恢复到原温度时,容器为真空且碳元素全部以正盐的形式存在,则CH4,O2,Na2O2的物质的量之比为。
在电火花点火的情况下,两者恰好完全反应后恢复到原温度时,容器为真空且碳元素全部以正盐的形式存在,则CH4,O2,Na2O2的物质的量之比为。
现有aA、bB、cC、dD、eE五种短周期元素,它们都是生命体不可缺少的重要元素。已知它们的原子序数有如下关系:a+b=c,a+c=d,c+d=e,B、D、E都有多种同素异形体。B的化合物种类与A的化合物种类何者更多,目前学术界还有争议,但有一点是肯定的,那就是没有第三种元素的化合物种数会超出它们。根据以上信息回答下列有关问题:
(1)写出C2A4的电子式。C2A4和A2D2既具有氧化性,又具有还原性,从化合价的角度解释C2A4和A2D2既具有氧化性又具有还原性的原因
。
(2)A和B可以形成很多种化合物,用电子式表示A和B形成的最简单化合物的形成过程: ,该化合物与CA3和A2D的熔点由高到低的顺序为(用化学式表示)。
,该化合物与CA3和A2D的熔点由高到低的顺序为(用化学式表示)。
(3)燃料电池是一种新型电池。由一种日常生活中最常见的有机物(分子式为B2A6D)与D的单质以KOH溶液为电解质组成电池,引起了人们的普遍重视。写出负极的电极反应式:。
(4)E的同素异形体中有一种通常情况下不稳定,在空气中极易自燃。CA3、A2D、EA3的热稳定性由强到弱的顺序为(用化学式表示)。
(10分) 在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1molXY2含有54mol电子。
(1)该融雪剂的化学式是;X与氢元素形成的化合物的电子式是。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是;D与E能形成一种非极性分子,该分子的结构式为;D所在族元素的氢化物中,沸点最低的氢化物的化学式是。
(3)元素W与Y同周期,其单质是一种良好的半导体材料;元素Z的单质分子Z2中由3个共价键;W与Z能形成一种新型无机非金属材料,其化学式是。
(4)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,此反应的离子方程式 。
。