硫酸亚铁铵的化学式为(NH4)2SO4·FeSO4·6H2O,又名莫尔盐,是分析化学中常见的还原剂。某化学研究小组设计如下实验来制备莫尔盐并测定硫酸亚铁铵的纯度。
步骤一:铁屑的处理与称量。在盛有适量铁屑的锥形瓶中加入Na2CO3溶液,加热、过滤、洗涤、干燥、称量,质量记为m1。
步骤二:FeSO4的制备。将上述铁屑加入到一定量的稀硫酸中,充分反应后过滤并用少量热水洗涤锥形瓶和滤纸。滤液及洗涤液完全转移至蒸发皿中。滤渣干燥后称重,质量记为m2。
步骤三:硫酸亚铁铵的制备。准确称取所需质量的(NH4)2SO4加入“步骤二”中的蒸发皿中,缓缓加热一段时间后停止,冷却,待硫酸亚铁铵结晶后过滤。晶体用无水乙醇洗涤并自然干燥,称量所得晶体质量。
步骤四:用比色法测定硫酸亚铁铵的纯度。
回答下列问题:
(1)步骤三中称取的(NH4)2SO4质量为________。
(2)①铁屑用Na2CO3溶液处理的目的是_______________________________。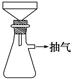
制备FeSO4溶液时,用右图装置趁热过滤,原因是
_______________________________________________________________。
②将(NH4)2SO4与FeSO4混合后加热、浓缩,停止加热的时机是
________________________________________________________________________。
③比色法测定硫酸亚铁铵纯度的实验步骤为:Fe3+标准色阶的配制、待测硫酸亚铁铵溶液的配制、比色测定。标准色阶和待测液配制时除均需加入少量稀盐酸外,还应注意的问题是________________________________________________________________________。
④该实验最终通过____________________确定硫酸亚铁铵产品等级。
在下列条件下能否发生离子反应?对能发生的写出离子方程式,不能发生的说明理由
(1)CH3COONa溶液与HCl溶液混和_________________________
(2)Ca(OH)2的澄清溶液与Na2SO4稀溶液混和____________________
(3)Ca(OH)2的澄悬浊液与Na2SO4浓溶液混和____________________
(4)CuCl2溶液与H2SO4溶液混和__________________________
现有甲、乙、丙、丁和Fe(OH)3五种胶体溶液,按甲和丙、乙和丁、丙和乙、乙和Fe(OH)3胶体两两混合,均出现胶体凝聚,则胶体微粒带负电荷的胶体溶液是 。
请按下列线条提示,画出Fe、Cu、S、H2、HCl、NaOH、H2So4、Ba(OH)2、NaHCO3、K2O、CuO、NaCl 的树状分类图: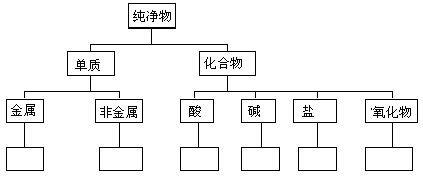
实验室制配0.5 mol/L的NaOH溶液500 mL,有以下仪器:①烧杯②100 mL量筒③1000 mL容量瓶④500 mL容量瓶⑤玻璃棒⑥托盘天平(带砝码) ⑦滴定管
(1)配制时,必须使用的仪器有____________(填代号),还缺少的仪器是____________。
(2)实验两次用到玻璃棒,其作用分别是:_____________、______________。
(3)配制时,一般可分为以下几个步骤:①称量②计算③溶解④摇匀⑤转移⑥洗涤⑦定容⑧冷却。其正确的操作顺序为______________。
有A、B、C、D、E5种元素,已知:
① A原子最外层电子数是次外层电子数的两倍,B的阴离子与C的阳离子跟氖原子的电子层结构相同,E原子第三层上的电子比第一层多5个。
② 常温下B2是气体,它对氢气的相对密度是16。
③ C的单质在B2中燃烧,生成淡黄色固体F。F与AB2反应可生成B2。
④ D的单质在B2中燃烧,发出蓝紫色火焰,生成有刺激性气味的气体DB2。D在DB2中的含量为50%。根据以上情况回答:
(1) A是________、B是________、C是________、D是________、E是________。(写元素符号)
(2) E的原子结构示意图为________________,C的离子结构示意图为________________。
(3) F和AB2反应的化学方程式为。