Q、R、X、Y、Z五种元素的原子序数依次递增。已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4。
请回答下列问题:
(1)Z2+ 的核外电子排布式是 。
(2)向ZSO4溶液中逐滴滴入R的氢化物的水溶液至过量,用离子方程式表示该过程的变化:
(3)在下图中画出[Z(NH3)4]2+离子中,Z2+与NH3分子形成的配位键。
(4)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是 。
a.稳定性:甲>乙,沸点:甲>乙 b.稳定性:甲>乙,沸点:甲<乙
c.稳定性:甲<乙,沸点:甲<乙 d.稳定性:甲<乙,沸点:甲>乙
(5)Q、R、Y三种元素的第一电离能数值由大到小的顺序为 (用元素符号作答)
(6)Q的一种氢化物相对分子质量为28,其中分子中的σ键与π键的键数之比为 。
在花瓶中加入“鲜花保鲜剂”,就会延长鲜花的寿命。下表是1 L“鲜花保鲜剂”中含有的成分,阅读后回答下列问题:
| 成分 |
质量(g) |
摩尔质量(g·mol-1) |
| 蔗糖 |
50.00 |
342 |
| 硫酸钾 |
0.50 |
174 |
| 阿司匹林 |
0.35 |
180 |
| 高锰酸钾 |
0.50 |
158 |
| 硝酸银 |
0.04 |
170 |
(1)下列“鲜花保鲜剂”的成分中,属于非电解质的是________。
A.蔗糖 B.硫酸钾
C.高锰酸钾 D.硝酸银
(2)“鲜花保鲜剂”中K+的物质的量浓度为(阿司匹林中不含K+)_____________mol·L-1。(保留两位有效数字)
(3)配制上述1 L“鲜花保鲜剂”所需的仪器有托盘天平、烧杯、玻璃棒、药匙、________、________。(在横线上填写所缺仪器的名称)
(4)配制过程中,下列操作对配制结果没有影响的是__________。
A.定容时仰视液面
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的NaCl溶液而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,但未做任何处理
某一反应体系中,有反应物和生成物共五种物质,这五种物质是:Cl2、KMnO4、MnCl2、H2O、HCl(浓)、KCl,其中Cl2、H2O均为生成物。
(1)该反应中的氧化剂是,氧化产物为。
(2)该反应中,氧化产物与还原产物的物质的量之比为。
(3)若产生的气体在标准状况下体积为2.24 L,则反应过程中转移电子的数目为NA(NA表示阿伏伽德罗常数的值),发生反应的KMnO4的质量为g。
化学科学在药物的开发、合成和使用中起着至关重要的作用。如小苏打、氢氧化铝、三硅酸镁等可治疗胃酸过多,硫酸亚铁可补铁、防治贫血。试回答下列问题:
(1)写出小苏打与胃酸(主要成分为稀盐酸)作用的离子方程式:。
(2)自选合适的氧化剂,将补铁剂中的Fe2+氧化成Fe3+,写出相关的离子反应方程式:____________________。
(3)检验Fe3+常用的试剂除碱外,还可以用(填化学式),现象是。
无机化合物可根据其组成和性质进行分类: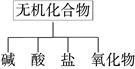
(1)右图所示的物质分类方法名称是 ;
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表②③⑥的后面;(只需填一种)
| 物质类别 |
酸 |
碱 |
盐 |
氧化物 |
| 化学式 |
①HCl ② |
③ ④Ba(OH)2 |
⑤Na2CO3 ⑥ |
⑦CO2 ⑧Na2O2 |
(3)写出⑦转化为⑤的离子方程式;
(4)呼吸面具中用⑧作为O2来源的反应原理为(用化学反应方程式表示)、;
( 14分)(1)3.6克H2O的物质的量是,含有个H2O,含有molH。
(2)3.01×1023个OH—的物质的量为,质量为,含有质子的物质的量为,含有电子的物质的量为。