铝分别与足量的氢氧化钠和稀盐酸溶液反应,当两个反应放出的气体在相同状况下体积相等时,反应中消耗的NaOH和HCl物质的量之比为
| A.2∶1 | B.3∶1 | C.1∶1 | D.1∶3 |
50g含有1.17g氯化钠和0.84g氟化钠的溶液中加入过量的硝酸银溶液,充分反应搅拌、静止、过滤、洗涤、干燥得到2.87g固体,由此得出的结论是
| A.氯离子只有一部分参加反应 |
| B.氟离子只有一部分参加反应 |
| C.氟化银难溶于水 |
| D.氟化钠和硝酸银在溶液中无沉淀生成 |
某澄清溶液,可能含有Ca2+、Na+、Cl-、CO32-、I-中的一种或几种,现做如下实验:①通入足量氯气,溶液变为棕黄色,滴加淀粉溶液后溶液显蓝色;②加入BaCl2有白色沉淀生成,再加入足量盐酸后,沉淀完全溶解,并有气体生成。 下列关于该澄清溶液的说法中错误的是
| A.一定含有I- | B.一定含有CO32- |
| C.可能含有Cl- | D.一定含有Ca2+ |
氯元素在自然界有35Cl和37Cl两种同位素,在计算式34.969×75.77%+36.966×24.23% =35.453中
| A.75.77%表示35Cl的质量分数 |
| B.24.23%表示35Cl的原子百分含量 |
| C.35.453表示氯元素的相对原子质量 |
| D.36.966表示37Cl的质量数 |
某氧原子的质量为ag,12C原子的质量为bg,且NA表示阿伏加德罗常数,下列说法中正确的是
A.氧元素的相对原子质量为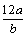 |
| B.1mol该氧原子质量为aNAg |
C.xg该氧原子所含的电子的个数为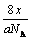 |
D.yg该氧原子的中子数一定为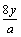 |
下列粒子中,与NH4+具有相同质子数和电子数的是
| A.OH— | B.F- | C.Na+ | D.NH3 |