某校化学兴趣小组参观碱式碳酸镁的生产后,知道了以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁[xMgCO3·yMg(OH)2·zH2O]的主要流程如下: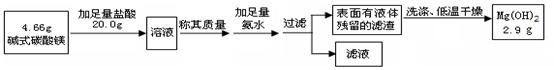
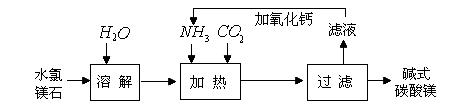
【问题讨论】
(1)上述流程中滤液的主要溶质(写化学式) ,检验其中阳离子要用的试剂有(填序号) 。
A. 氧化钙 B. 稀盐酸 C. 紫色石蕊试液 D. 硫酸钠溶液
(2)上述流程中NH3被循环使用,流程中生成NH3的化学方程式为 。
(3)流程中“加热” 这一环节每生成l个分子xMgCO3·yMg(OH)2·zH2O需消耗氨的分子数为 (用代数式)。
(4)判断碱式碳酸镁是否洗涤干净,可以采取向最后的洗出液中滴加(填序号) ,然后观察现象判断。
A. 盐酸和氯化钡的混合液 B. 硝酸和硝酸银的混合液 C.碳酸钠溶液 D.稀盐酸
【组成探究一】
(5)已知高温煅烧碱式碳酸镁得到MgO,用下列装置设计实验测定碱式碳酸镁的组成,装置连接从左到右依次为A→ → →D。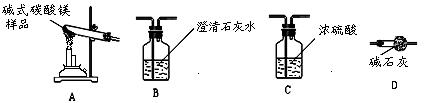
(6)取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g、CO21.76g,通过计算确定碱式碳酸镁的化学式为 。。
计算过程(3分)
【组成探究二】
(7)有同学对用盐酸有异议,认为用硫酸更好。你的看法是(填序号) ;
A.同意 B. 不同意 C. 不确定
你的理由是 。
(8)称得的溶液质量为 g [提示:可用⑹中数据]
【组成探究三】
更为精确的测量碱式碳酸镁受热分解过程中时间与剩余固体质量,作出如下的坐标图
(9)试回答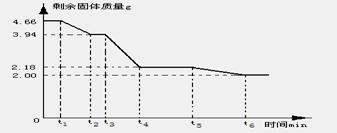
①加热时,该晶体开始发生化学变化的时刻是 (填“t1”、“t3”或“t5”)。
②t4~t5时间段固体为(写化学式) 和MgO的混和物。
③t2~t3时间段固体的化学式为(用含x、y的化学式也算对) 。
达州盛产天然气,有“中国气都”之称的美誉。天然气的主要成分是甲烷(CH4),我校化学兴趣小组的同学对甲烷燃烧的产物产生了兴趣,请你参与:
【提出问题】甲烷燃烧后生成哪些物质?
【查阅资料】含碳元素的物质完全燃烧生成CO2,不完全燃烧生成CO;无水CuSO4遇水变蓝。
【猜想与假设】
甲 CO2 H2O ;乙 CO H2O;
丙 NH3CO2 H2O;丁 CO2 CO H2O 。
你认为同学的猜想是错误的,理由是。
【实验探究】为了验证上述猜想与假设,将甲烷在一定量的O2中燃烧的产物依次通过下列装置: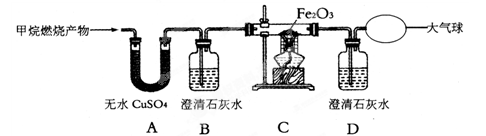
A、B装置的顺序能否颠倒?(填“能"或“否”)。
实验中观察到A中无水CuSO4变蓝,B、D中澄清石灰水变浑浊,C中红色粉末变成黑色,由此推断同学猜想成立。
请写出C中硬质玻璃管内发生反应的化学方程式:。
小聪同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬。好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,邀请你一同参加。
【作出猜想】
猜想1.Cr>Fe>Cu;猜想2. Fe>Cu >Cr;猜想3.你的猜想是。
【查阅资料】
(1)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
【设计与实验】
小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸。
【结论与解释】
(1)小聪得到的结论是猜想正确。
(2)实验前用砂纸打磨金属片的目的是。
【知识运用】
将铬片投入FeSO4溶液中,反应(填“能”或“不能”)进行。若能进行,
请你写出反应的化学方程式。
小华同学配制50g溶质质量分数为20%的NaCl溶液,操作流程如图:
(1)小华同学应称取氯化钠的质量是g,量取水体积为mL
(2)指出图中的一处错误:
(3)在用托盘天平称取食盐的过程中,发现指针已偏向分度盘左侧,他接下来的操作是
(4)如果小华配制的氯化钠溶液的溶质质量分数小于20%,则造成此误差的可能原因有(填序号)。
A.称量前天平没有调平
B.称量纸上残留少量食盐
C.向烧杯中加水时,有少量水溅出烧杯外
明星化学兴趣小组就空气中氧气的含量进行实验探究.
【集体讨论】
(1)讨论后同学们认为,选择的药品既要能消耗氧气,又不会跟空气中的其他成分反应,而且生成物为固体。他们应该选择(填编号).
| A.蜡烛 | B.红磷 | C.硫粉 | D.光亮的铁丝 |
为了充分消耗容器中的氧气,药品的用量应保证.
(2)小组同学共同设计了如下图的两套装置,你认为合理的是(填编号).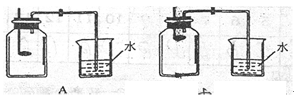
为了确保实验的成功,在装药品之前应该.
【分组实验】
在讨论的基础上,他们分组进行了实验.
【数据分析】
实验结束后,整理数据见下表.(注:集气瓶容积为100 mL)
| 组别 |
1 |
2 |
3 |
4 |
5 |
6 |
| 进入集气瓶中水的体积(mL) |
20 |
21 |
19 |
20 |
22 |
18 |
(3)通过对实验结果的交流,大多数同学都验证出氧气约占空气体积的.通过实验还可推断集气瓶中剩余气体的性质是.
某研究小组在学习氧气的化学性质时发现:铁丝燃烧没有火焰,蜡烛燃烧却有明亮的火焰。该小组同学进行了如下探究.
(1)写出铁丝在氧气中燃烧的文字表达式:。
(2)探究一:蜡烛燃烧产生火焰的原因是什么?
点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生(如图)由此可知:蜡烛燃烧产生的火焰是由(填:“固态”或“气态”)物质燃烧形成的.
(3)探究二:物质燃烧产生火焰的根本原因是什么?
【查阅资料】
| 物质 |
熔点/℃ |
沸点/℃ |
燃烧时温度/℃ |
| 石蜡 |
50~70 |
300~550 |
约600 |
| 铁 |
1535 |
2750 |
约1800 |
| 钠 |
97.8 |
883 |
约1400 |
由上表可知:物质燃烧能否产生火焰与其(填:“溶点”或“沸点”)和燃烧时温度有关。由此推测:钠在燃烧时,(填:“有”或“没有”)火焰产生.
(4)木炭在氧气中燃烧没有火焰,但生活中木炭燃烧时往往会产生火焰,其原因可能是.