如图,将潮湿的Cl2通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂(足量)可能是( )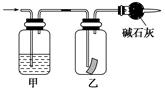
①浓硫酸 ②NaOH溶液 ③KI溶液 ④饱和食盐水
| A.①② | B.②③ |
| C.①②③ | D.①②③④ |
与250 mL 0.4 mol·L-1稀硫酸中的c(H+)相等的是
| A.100 mL 2 mol·L-1的盐酸溶液 |
| B.25 mL 0.8 mol·L-1的稀HNO3溶液 |
| C.100 mL 1 mol·L-1的稀H2SO4溶液 |
| D.250 mL 0.4 mol·L-1的稀盐酸溶液 |
对于某些离子的检验及结论一定正确的是
| A.加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C.加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
| D.加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+ |
下列实验操作中正确的是
| A.蒸发操作中应使水分完全蒸干后,才能停止加热 |
| B.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大 |
| C.分液操作时,下层液体从分液漏斗下口放出后,再将上层液体从下口放出到另一个烧杯中 |
| D.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
下列各组中两种物质在溶液中的反应可用同一离子方程式表示的是
| A.Cu(OH)2 + HCl;Cu(OH)2 + CH3COOH |
| B.NaHCO3 + H2SO4;Na2CO3 + HCl |
| C.NaHCO3 + NaOH;Ca(HCO3)2 + NaOH |
| D.BaCl2 + H2SO4;Ba(OH)2 + Na2SO4 |
两个体积相同的容器,一个盛有NO,另一个盛有N2和O2,在同温同压下两容器内的气体一定具有相同的
①原子总数; ②质子总数; ③分子总数; ④质量
| A.①② | B.②③ | C.①③ | D.②④ |