下列说法不正确的是
A.已知冰的熔化热为6.0 kJ/mol,冰中氢键键能为20 kJ/mol,假设1 mol冰中有2 mol氢键,且熔化热完全用于破坏冰的氢键,则最多只能破坏冰中15%的氢键
B.同温同压下, )在光照和点燃条件的△H相同
)在光照和点燃条件的△H相同
C.根据碘与氢气反应的热化学方程式
①
②
则反应②的反应物总能量比反应①的反应物总能量低
D.已知一定温度下,醋酸溶液的物质的量浓度为c,电离度为a, 。若加入少量醋酸钠固体,则CH3COOH;—一CH3COO -十H+向左移动,a减小,Ka变小若加入少量醋酸钠固体,则
。若加入少量醋酸钠固体,则CH3COOH;—一CH3COO -十H+向左移动,a减小,Ka变小若加入少量醋酸钠固体,则
 十H+向左移动,a减小,Ka变小
十H+向左移动,a减小,Ka变小
下列措施中,能减慢化学反应速率的是
A.用MnO2作H2 O2分解反应的催化剂
O2分解反应的催化剂
B .把石灰石固体研细后与盐酸反应
.把石灰石固体研细后与盐酸反应
C.把盛有Cu和稀硝酸的试管浸泡在热水中
D.用10%的H2SO4溶液代替30%的H2SO4溶液与锌粒反应
下列能为人体提供能量的营养物质中,属于高分子化合物的是
| A.蔗糖 | B.油脂 | C.葡萄糖 | D.蛋白质 |
对于某些离子的检验及结论正确的是
| A.加盐酸有无色气体产生,该气体能使澄清石灰水变混浊,原溶液中一定有CO32— |
| B.加氯化钡溶液有白色沉淀产生,再加盐酸,淀淀不消失,原溶液中一定有SO42- |
| C.加氢氧化钠溶液加热产生的气体使湿润红色石蕊试纸变蓝,原溶液中一定有NH4+ |
| D.加入NaOH后溶液中先产生白色沉淀后又消失,原溶液中一定有Mg2+ |
配制一定物质的量浓度的NaOH溶液,下列情况,会使配制的结果偏高的是
A.用滤纸称量NaO H固体 H固体 |
B.未洗涤烧杯和玻璃棒 |
| C.容量瓶中原来含有少量蒸馏水 | D.定容时俯视刻度线观察液面 |
在一定温度下的定容密闭容器中,下列情况表明反应A(s)+2B(g) 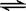 C(g)+D(g) 已达到反应限度的是
C(g)+D(g) 已达到反应限度的是
| A.混合气体的密度保持不变 | B.有1mol C生成的同时有1mol D生成 |
| C.混合气体的总物质的量保持不变 | D.有1 mol A生成的同时有1mol C消耗 |