为验证氧化性Cl2 > Fe3+ > SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。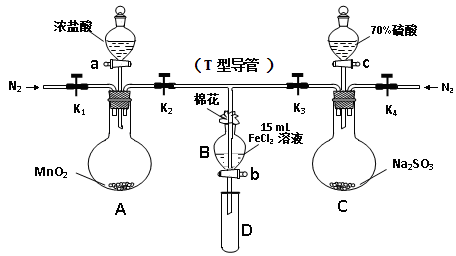
实验过程:
Ⅰ.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中, 继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,加热A。
Ⅲ.当B中溶液变黄时,停止加热,夹紧K2。
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,并检验其中的离子。
Ⅴ.打开K3和活塞c,加入70%的硫酸,一段时间后夹紧K3。
Ⅵ.更新试管D,重复过程Ⅳ。
(1)过程Ⅰ的目的是 。
(2)棉花中浸润的溶液为 。
(3)A中发生反应的化学方程式为 。
(4)能说明氧化性Fe3+ > SO2的离子方程式是 。
(5)过程Ⅵ,检验B溶液中是否含有SO42-的操作是 。
(6)甲、乙、丙三位同学分别完成了上述实验,他们的检测结果不能够证明氧化性Cl2 > Fe3+ > SO2的是 (填“甲”“乙”“丙”),请用必要的文字说明理由 。
| |
过程Ⅳ B溶液中含有的离子 |
过程Ⅵ B溶液中含有的离子 |
| 甲 |
有Fe3+无Fe2+ |
有 Fe2+ |
| 乙 |
既有Fe3+又有Fe2+ |
有SO42- |
| 丙 |
有Fe3+无Fe2+ |
有SO42- |
(7)进行实验过程Ⅴ时,B中溶液颜色由黄色逐渐变为红棕色,停止通气,放置一段时间后溶液颜色变为浅绿色。
查阅资料: Fe2+(aq)+ SO32- (aq)  FeSO3(s)(墨绿色)提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。
FeSO3(s)(墨绿色)提出假设:FeCl3与 SO2的反应经历了中间产物FeSO3,溶液的红棕色是FeSO3(墨绿色)与FeCl3(黄色)的混合色。
某同学设计如下实验,证实该假设成立:
① 溶液E和F分别为 、 (写化学式)。
②请用化学平衡原理解释步骤3中红棕色溶液颜色变为浅绿色的原因 。
请从下图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积,并检验氯气。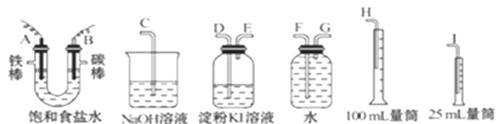
(1)A极发生的电极反应式是______ _______
_______ ______,
______,
B极发生的电极反应式是_______________________。
(2)设计上述气体实验装置时,各接口的正确连接顺序为:
A接______、 _____接______ ;B接_____ 、 _____接______ 。
(3)证明产物中有Cl2的实验现象是______。
(4)已知电解后测得产生的H2的体积为44.8 mL(已经折算成标准状况),电解后溶液的体积为50 mL,此时溶液中NaOH的物质的量浓度为:________。
通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的的质量确定有机物的组成。下图所示的是用燃烧法确定有机物物分子式的常用装置。

回答下列问题:
现准现准确称取0.44 g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重0.88 g,B管增重0.36g。请回答:按上述所 给的测量信息,回答问题:
给的测量信息,回答问题:
(1)A、B管内均盛有有固态试剂,A管的作用是______________________;
(2)E中应盛装什么试剂:_______________;
(3)如果把CuO网去掉,A管重量将____;(填“增大”、“减小”、或“不变”)
(4)请改进这套装置的一个不足之处:;
(5)该有 机物的实验式为__________________;
机物的实验式为__________________;
(6)要确定该有机物的分子式,还必须知道的数据是。
甲、乙两同学欲分别完成“钠与氯气反应”的实验。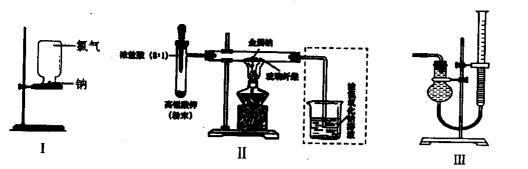
I.甲同学的方案为:取一块绿豆大的金属钠(切去氧化层),用滤纸吸净煤油,放在石棉网上,用酒精灯微热。待钠熔成球状时,将盛有氯气的集气瓶迅速倒扣在钠的上方(装置如图I)。该方案的不足之处有(至少答出两点)。
II.乙同学所采用的装置如图Ⅱ,回答下列问题:
(1)按图Ⅱ组装仪器、添加药品,实验开始后,先将浓盐酸挤入试管,试管中发生反应的离子方程式为;待装置中出现现象后,点燃酒精灯。
(2)点燃酒精灯后,玻璃管中出现的现象是。(至少答出三点)
(3)乙同学欲将虚框内装置改为图Ⅲ所示装置,并测量多余气体的体积。
①若图Ⅲ所示量气装置由干燥管、乳胶管和50mL滴定管组装而成,此处所用滴定管是(填“酸式”或“碱式”)滴定管。
②为提高测量的准确性,图Ⅲ装置中的液体可用;收集完气体并冷却至室温后读数,读数前应进行的操作是。
③如果开始读数时操作正确,最后读数时俯视右边滴定管液面,会导致所测气体的体积(填“偏大”、“偏小”或“无影响”)。
中学化学中常见的几种物质存在如下关系,其中甲是黑色非金属单质,乙是生活中常见的金属单质,D是红棕色气体。(图中部分产物和反应条件已略去)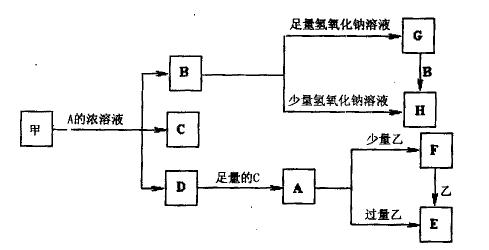
回答下列问题:
(1)写出甲与A的浓溶液反应的化学方程式。
(2)将等体积等浓度的G溶液和H溶液混合后得到的溶液中的离子浓度大小关系为。
(3)除去G固体中含有H杂质采用的方法是。
(4)A溶液与一种能使湿润的红色石蕊试纸变蓝色的气体反应,生成一种盐,该盐的溶液呈酸性,其原因是(用离子方程式表示)。
(5)写出向E溶液中加入少量稀硫酸后反应的离子方程式
。
将溶液F加热蒸干、灼烧到质量不再减少时所得固体物质的化学式为。
(6)确定E中阳离子实验的方法为。
某研究性学习小组通过实验来探究乙二酸(又名草酸)受热分解的产物,他们设计的实验装置如下图所示:
 查阅资料可知:乙二酸晶体(H2C2O4·2H2O)熔点100.1 ℃,草酸钙是难溶于水的白色固体;Cu2O能溶于稀硫酸,立即发生歧化反应生成Cu2+和Cu。
查阅资料可知:乙二酸晶体(H2C2O4·2H2O)熔点100.1 ℃,草酸钙是难溶于水的白色固体;Cu2O能溶于稀硫酸,立即发生歧化反应生成Cu2+和Cu。
(1)实验过程中观察到C、E装置中的溶液均变浑浊,且D装置中黑色粉末变为红色,写出A中发生反应的化学方程式:;
(2)装置B的作用是;上述装置中有两处需要改进(假设洗气装置每次吸收气体均完全),改进方法是;。
(3)实验结束后向装置B的试管中加入NaHCO3溶液,产生大量无色气体,由此可以证明两种物质的酸性强弱顺序是。
(4)有人认为D装置中得到的红色固体可能是Cu,也可能是Cu和Cu2O的混合物。实验小组 进一步探究:
进一步探究:
①取少量红色固体加入到盛稀硫酸的试管中,充分振荡,溶液变为蓝色,试管底部仍有红色固体,由此可以得出的结论是。
②取6.8g红色固体与足量的稀硝酸反应,收集到标准状况下的NO气体1.12L。则红色固体中含单质铜的质量分数是。