分类方法在化学学科的发展中起到了非常重要的作用。下列分类标准合理的是
① 根据物质所含元素种类,将物质分为单质、化合物等
② 根据反应中是否有电子得失,将化学反应分为氧化还原反应和非氧化还原反应
③ 根据分散系是否具有丁达尔现象,将分散系分为溶液、胶体和浊液
④ 根据物质在反应中得电子数的多少,将氧化剂分为强氧化剂和弱强氧化剂
| A.① | B.①② | C.①②④ | D.②③④ |
在标准状况下,将CO2和CO的混合气体(标准状况下,该混合气体平均相对分子质量为32)充满一盛有足量Na2O2的容积为22.4 L的密闭容器中,用间断的电火花引发至充分反应。反应完全后容器里的存在物叙述正确的是 ( )
| A.存在0.5 mol的CO | B.存在0.25 mol的Na2CO3 |
| C.存在0.125 mol的O2 | D.存在0.75 mol的Na2CO3 |
如右图所示装置进行实验(图中铁架台等仪器均已略去)。在Ⅰ中加入试剂后,塞紧橡皮塞,立即打开止水夹,Ⅱ中有气泡冒出;一段时间后关闭止水夹,Ⅱ中液面上升,溶液由无色变为浑浊。不符合以上实验现象的Ⅰ和Ⅱ中应加入的试剂是 ( )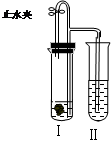
| A |
B |
C |
D |
|
| Ⅰ |
CaCO3、稀HCl |
NaHCO3、稀H2SO4 |
Fe、稀H2SO4 |
Al、稀NaOH |
| Ⅱ |
AgNO3 |
MgCl2 |
NaOH |
AlCl3 |
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子是:( )
| A.H+、Mg2+、Al3+ | B.Mg2+、Al3+、Fe2+ |
| C.H+、Ba2+、Al3+ | D.只有Mg2+、Al3+ |
向一定量的Fe、FeO、Fe2O3的混合物中,加入100 mL 1 mol/L的盐酸,恰好使混合物完全
溶解,放出224 mL的气体(标准状况),所得溶液中加入KSCN溶液无血红色出现,那么用
足量的CO在高温下还原相同质量的此混合物,得到单质铁的质量为( )
| A.11.2克 | B.2.8克 | C.5.6克 | D.无法计算 |
下列除杂质的操作方法正确的是()
| A.二氧化硅中有少量的氧化铝:加过量的烧碱溶液后过滤 |
| B.NH4Cl中有少量的I2:通过加热的方法 |
| C.Na2CO3溶液(Na2SO4):加入适量Ba(OH)2溶液,过滤 |
| D.CO2气体(HCl):通过饱和NaHCO3溶液后干燥 |