下列实验能证明SO2存在的是( )
①能使澄清的石灰水变浑浊 ②能使湿润的蓝色石蕊试纸变红 ③能使湿润的品红试纸褪色 ④通入足量的NaOH溶液,再加BaCl2溶液有白色沉淀生成 ,该沉淀溶于稀盐酸 ⑤通入氯水能使氯水褪色,再滴加BaCl2溶液有白色沉淀生成
| A.都不能证明 | B.③④⑤能证明 |
| C.③⑤能证明 | D.只有⑤能证明 |
已知CH4(g)+2O2(g)="=" CO2(g)+2H2O(l); ΔH=--Q1kJ·mol-1 ,  =2H2O(g);△H2=--Q2 kJ·
=2H2O(g);△H2=--Q2 kJ· ,
, =2H2O(l);△H2=--Q3 kJ·
=2H2O(l);△H2=--Q3 kJ· 。
。
常温下,取体积比4∶1的甲烷和氢气的混合气体11.2L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为()
| A.0.4Q1+0.05Q3 | B.0.4Q1+0.05Q2 | C.0.4Q1+0.1Q3 | D.0.4Q1+0.2Q2 |
1g碳与适量水蒸气反应生成CO和H2,需吸收10.94KJ热量,此反应的热化学方程式为
| A.C + H2O ="=" CO + H2 ; ΔH="=" +131.3KJ·mol— |
| B.C(s)+ H2O(g) ="=" CO(g) + H2(g) ; ΔH="=" +10.94KJ·mol— |
| C.C(s)+ H2O(l) ="=" CO(g) + H2(g) ; ΔH="=" +131.3KJ·mol— |
| D.C(s)+ H2O(g) ="=" CO(g) + H2(g) ; ΔH== +131.3KJ·mol— |
在2A+B 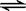 3C+4D中,表示该反应速率最快的是
3C+4D中,表示该反应速率最快的是
A.υ(A) = 0.5mol·L-1·S-1 B.υ(B) =" 0.3" mol·L-1·S-1
C.υ(C) = 0.8mol·L-1·S-1 D.υ(D)=" 1" mol·L-1·S-1
某温度下,浓度都是1 mol/L的两种气体X2和Y2,在密闭容器中反应生成气体Z,达到平衡后X2为0.4 mol/L,Y2为0.8mol/L,生成的Z为0.4mol/L ,则该反应式是
A.X2 + 2Y2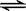 2XY2 2XY2 |
B.2X2 + Y2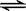 2X2Y 2X2Y |
C.3X2 + Y2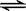 2X3Y 2X3Y |
D.X2 + 3Y2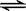 2XY3 2XY3 |
下列实验设计方案中,可行的是
| A.用加入适量铜粉的方法除去Cu(NO3)2溶液中的AgNO3杂质 |
| B.用洗气瓶中的NaOH溶液除去CO2气体中混有的HCl气体 |
| C.向某无色溶液中仅加入BaCl2溶液,以检验未知溶液中的SO |
| D.先后添加石蕊试液、BaCl2溶液,可将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种溶液鉴别开 |